
肠道与大脑的秘密通话
过去,肠道与大脑长期被视为功能相对独立的器官,二者的关联性并未得到关注。然而,随着神经科学、胃肠病学及交叉研究的不断深入,一个由神经通路、内分泌系统、免疫调控机制和代谢通路共同构成的复杂双向通信网络-"肠-脑轴"被揭示。这一系统的发现,为理解神经系统疾病与胃肠功能紊乱的共病机制提供了革命性的理论依据。
肠-脑"双向"通路的发现
2018年,杜克大学Kaelberer团队通过高分辨率成像技术,首次证实肠道神经上皮细胞与迷走神经传入纤维之间存在直接的突触连接,从而确立了肠脑间的"第一级"神经通路,使肠道信号能够以毫秒级速度上传至脑干孤束核[1]。后续的相关研究进一步揭示了这条通路的双向性:不仅肠道微生物代谢产物可藉此调节迷走神经张力[2],中枢神经系统也可以通过下行通路对肠道环境进行快速的反馈[3]。这些发现从结构到功能完整揭示了肠脑双向通信的神经基础,为相关机制研究提供了关键理论支撑。而这一高速的神经通路,与免疫、内分泌等信号途径共同构成了一个更为复杂的"多维通信网络",精细调控着脑肠轴的稳态。
脑肠轴的细胞与分子机制:多维通信网络
肠脑轴的通信机制涉及多种细胞类型和分子途径:
关键信号转换器--肠道嗜铬细胞:这些散布于肠上皮的细胞能够敏锐感知肠道腔内环境变化,并释放血清素、γ氨基丁酸等神经活性物质,以神经递质的形式激活相邻的迷走神经末梢,完成化学信号到神经信号的转换[4]。
"第二大脑"--肠神经系统(ENS):作为一个独立的神经网络,ENS包含约1~5亿个神经元,能够自主协调肠道复杂功能。它通过迷走神经等通路与中枢神经系统保持密切的双向化学与电信号联系。
核心调节者--肠道微生物群:肠道微生物通过多种机制深度参与肠脑通信。a. 代谢途径。微生物发酵膳食纤维产生的短链脂肪酸(如丁酸、丙酸)可通过血液循环穿越血脑屏障,发挥神经保护与调节作用[5]。b. 神经内分泌途径。微生物自身可合成或影响宿主合成血清素、多巴胺、去甲肾上腺素等神经活性物质,尽管大部分肠道来源的神经递质不直接通过血脑屏障,但能显著影响外周和ENS功能[6]。c. 免疫调节途径。微生物通过调节白细胞介素、肿瘤坏死因子-α等细胞因子水平,影响全身及神经炎症过程[7]。d. 系统整合途径。微生物群能影响下丘脑-垂体-肾上腺轴的应激反应强度[8]。
值得注意的是,肠屏障与血脑屏障的功能完整性在信号传递中起着协同"网关"作用,而中枢的胶质细胞(如星形胶质细胞)也被发现是肠脑信号的重要中转站[9]。
脑肠轴与疾病病理生理学
肠脑轴功能失调是多种神经系统疾病的核心病理环节之一。
抑郁症:此类患者常伴有肠道微生物组成改变(如菌群多样性下降)和肠屏障功能受损("肠漏"),导致系统性低度炎症,进而影响大脑功能[10]。
自闭症谱系障碍(ASD):ASD儿童胃肠道症状(如便秘、腹泻)的发生率显著高于正常发育儿童,且其严重程度与核心行为异常呈正相关[11]。
帕金森病(PD):病理学研究显示,α突触核蛋白的异常聚集可能首先出现在ENS,随后通过迷走神经通路,以类似"朊病毒"的方式传播至中枢神经系统,这为PD的起源提供了新解释[12]。
治疗干预的新策略:靶向脑肠轴
基于肠脑轴理论的干预策略为神经系统疾病治疗开辟了新方向。
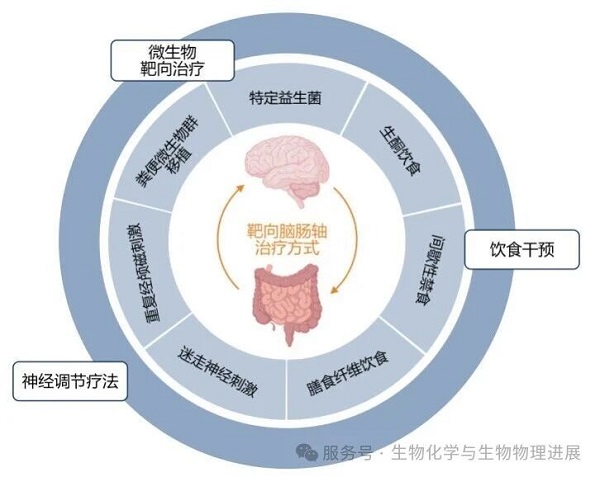
微生物靶向治疗:
特定益生菌(又称"psychobiotics"),如罗伊氏乳杆菌JB-1、长双歧杆菌1714等,在临床试验中显示出减轻压力和改善焦虑的潜力[13]。粪便微生物群移植在动物模型中能够逆转部分行为异常,展示了微生物生态重塑的治疗前景[9]。
饮食干预:
富含膳食纤维的饮食可促进微生物产生短链脂肪酸,已被证实具有抗炎和神经保护作用[14]。生酮饮食、间歇性禁食等饮食模式通过快速改变微生物组成,影响宿主代谢与神经功能。
神经调节疗法:
迷走神经刺激已被批准用于治疗难治性抑郁症,其作用机制与逆向调节肠脑通信、抑制炎症反应密切相关[15]。重复经颅磁刺激也已被批准用于抑郁症,目前正积极研究用于治疗肠易激综合征,特别是伴有严重腹痛和焦虑或抑郁的患者。
展 望
目前,肠脑轴的相关研究仍在深入,尽管其中机制复杂重重,但随着生物技术与跨领域的协同创新,我们或将很快见证脑肠轴信号通路更加精细化的阐述,靶向肠脑轴治疗也将迈向个性化,为相关疾病患者提供精准干预方案。
参考文献
1. Kaelberer M M, Buchanan K L, Klein M E, et al. A gut-brain neural circuit for nutrient sensory transduction. Science, 2018, 361(6408): eaat5236
2. Liu W W, Reicher N, Alway E, et al. A gut sense for a microbial pattern regulates feeding. Nature, 2025, 645(8081): 729-736
3. Muller P A, Schneeberger M, Matheis F, et al. Microbiota modulate sympathetic neurons via a gut-brain circuit. Nature, 2020, 583(7816): 441-446
4. Touhara K K, Rossen N D, Deng F, et al. Topological segregation of stress sensors along the gut crypt-villus axis. Nature, 2025, 640(8059): 732-742
5. Pu D, Jin Y, Wang L, et al. Combined supplementation of short-chain fatty acids reduces hyperphosphorylation of Tau at T181, T231 and S396 sites and improves cognitive impairment in a chemically induced AD mouse model via regulation of HDAC and Keap1. Neurochem Int, 2025, 189: 106034
6. Li G, Dong S, Liu C, et al. Serotonin signaling to regulate energy metabolism: a gut microbiota perspective. Life Metab, 2024, 4(2): loae039
7. White Z, Cabrera I, Mei L, et al. Gut inflammation promotes microbiota-specific CD4 T cell-mediated neuroinflammation. Nature, 2025, 643(8071): 509-518
8. Qing W, Chen H, Ma X, et al. Gut dysbiosis-induced vitamin B6 metabolic disorder contributes to chronic stress-related abnormal behaviors in a Cortisol-independent manner. Gut Microbes, 2025, 17(1): 2447824
9. Zhang Y, Huang R, Cheng M, et al. Gut microbiota from NLRP3-deficient mice ameliorates depressive-like behaviors by regulating astrocyte dysfunction via circHIPK2. Microbiome, 2019, 7(1): 116
10. Park A J, Collins J, Blennerhassett P A, et al. Altered colonic function and microbiota profile in a mouse model of chronic depression. Neurogastroenterol Motil, 2013, 25(9): 733-e575
11. Al-Beltagi M, Saeed N K, Bediwy A S, et al. Role of gastrointestinal health in managing children with autism spectrum disorder. World J Clin Pediatr, 2023, 12(4): 171-196
12. Woerman A L, Watts J C, Aoyagi A, et al. α-synuclein: multiple system atrophy prions. Cold Spring Harb Perspect Med, 2018, 8(7): a024588
13. Allen A P, Hutch W, Borre Y E, et al. Bifidobacterium longum 1714 as a translational psychobiotic: modulation of stress, electrophysiology and neurocognition in healthy volunteers. Transl Psychiatry, 2016, 6(11): e939
14. Yan K, Wang X, Wang F, et al. The association between dietary fiber intake and cognitive function: mediating role of inflammatory markers. Front Nutr, 2025, 12: 1638315
15. Bonaz B, Sinniger V, Pellissier S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. J Physiol, 2016, 594(20): 5781-5790
作者简介
王鑫蝶:三峡大学基础医学院硕士研究生。研究方向:药物靶点发掘与分子药理学。
(作者:王鑫蝶)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: