
铁死亡:定向瓦解三阴性乳腺癌的新策略
在人类与乳腺癌的漫长斗争中,科学家一直在寻找能够精准杀伤癌细胞而不伤害正常细胞的理想武器。传统的放疗、化疗如同"地毯式轰炸",在杀伤癌细胞的同时也给正常组织带来严重损伤。然而,随着对细胞死亡机制研究的深入,一种名为"铁死亡"的新型细胞死亡方式,正为这场战役带来革命性突破,它犹如一枚能够精准识别并潜入癌细胞内部的特制炸弹,从内部瓦解这个顽固的敌人。
乳腺癌治疗的困境与转机
乳腺癌是全球女性中最常见的恶性肿瘤。目前已成为威胁女性健康的头号癌症杀手。更令人担忧的是,乳腺癌具有高度的异质性,其中三阴性乳腺癌是最具挑战性的亚型[1]。
三阴性乳腺癌因其缺乏雌激素受体、孕激素受体和人类表皮生长因子受体2这三个关键治疗靶点,而被称为"乳腺癌之王"。这意味着常规的内分泌治疗和靶向治疗对此类患者基本无效,化疗仍是主要治疗手段,但效果有限且易产生耐药性。此亚型的乳腺癌更具侵袭性,容易发生早期转移,且患者预后普遍较差[2]。
然而,科学家们在深入研究三阴性乳腺癌的代谢特性时,发现了一个转机:这种凶险的癌症亚型对铁死亡表现出异常的高度敏感性。这一发现为攻克三阴性乳腺癌开辟了全新战场。
铁死亡:癌细胞内的精密爆破工程
铁死亡是一种于2012年首次被明确定义的新型程序性细胞死亡方式。与传统的细胞凋亡不同,铁死亡的核心特征是铁依赖性的脂质过氧化积累,最终导致细胞膜系统的全面崩溃[3]。
想象一下这样的场景:在癌细胞内部,正在进行一场缓慢而不可逆的"金属锈蚀"过程。这个过程的独特之处在于,它充分利用了癌细胞自身的代谢特点--为了维持快速增殖,癌细胞需要大量铁元素参与DNA合成和能量代谢,同时需要丰富的多不饱和脂肪酸来构建新的细胞膜。这些本是癌细胞赖以生存的物质,在特定条件下却成了致命的"内应"。
为何三阴性乳腺癌对铁死亡如此脆弱?
三阴性乳腺癌对铁死亡的高度敏感性源于其独特的代谢特征。研究表明,三阴性乳腺癌细胞表面的转铁蛋白受体表达水平显著高于其他乳腺癌亚型,这使得它们能够更有效地从微环境中摄取铁离子[4]。
同时,三阴性乳腺癌细胞的代谢重编程导致谷氨酰胺代谢异常活跃。谷氨酰胺不仅是蛋白质合成的原料,还通过转化为谷氨酸,参与细胞内最重要的抗氧化物质--谷胱甘肽的合成。这一代谢特性使得三阴性乳腺癌细胞高度依赖完整的抗氧化防御系统来维持生存。
此外,三阴性乳腺癌细胞膜上富含多不饱和脂肪酸,这些脂肪酸的双键结构容易受到自由基攻击,成为脂质过氧化的"燃料"。
当这三个因素同时存在时,三阴性乳腺癌细胞就如同一个堆满易燃物的仓库,只需一点火星就能引发连锁爆炸[5]。
铁死亡的关键爆破点:两条核心通路
调控铁死亡的两条核心通路,已经成为了诱导癌细胞死亡的关键开关。
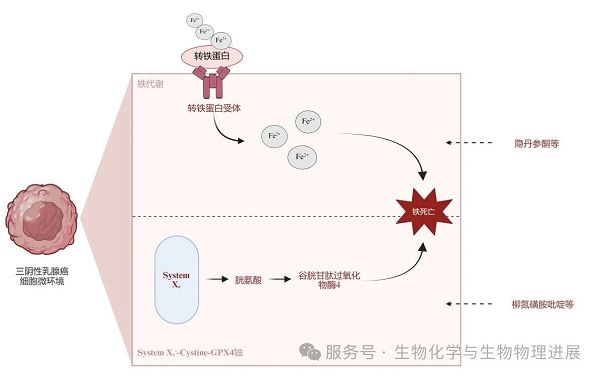
System Xc--Cystine-GPX4防御轴:关闭消防系统
该轴是细胞对抗铁死亡的核心"消防系统"。System Xc-是一个位于细胞膜上的氨基酸反向转运蛋白,负责将细胞外的胱氨酸转运入细胞内,同时将谷氨酸转运到细胞外[6]。进入细胞的胱氨酸被用于合成谷胱甘肽。谷胱甘肽随后作为辅酶,激活谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)--这是迄今发现的唯一能够直接还原细胞膜上脂质过氧化物的关键酶。GPX4就像是细胞内的"消防员",负责扑灭脂质过氧化这把火。
当System Xc-被抑制时,胱氨酸摄取受阻,谷胱甘肽合成原料断绝,GPX4活性随之下降,细胞的抗氧化防御系统全面崩溃[7]。此时,即使是正常生理状态下产生的脂质过氧化物也无法被及时清除,最终积累至致死水平。
铁代谢紊乱:提供爆破燃料
铁死亡的另一关键环节是细胞内铁的代谢紊乱[8]。三阴性乳腺癌细胞表面的转铁蛋白受体过度表达,导致细胞内铁离子异常积累。这些过量的二价铁离子通过芬顿反应,将细胞内微量的过氧化氢转化为高活性的羟基自由基。这些羟基自由基会攻击细胞膜上的多不饱和脂肪酸,引发脂质过氧化的链式反应,导致细胞膜系统彻底瘫痪。
临床转化的新策略
基于这些机制,科学家开发出多种诱导三阴性乳腺癌铁死亡的策略:
老药新用
◆ 柳氮磺胺吡啶被发现能有效抑制System Xc-,切断癌细胞的抗氧化防御。
◆ 二甲双胍通过调控microRNA-324-3p/GPX4轴,促进铁死亡发生。
◆ 辛伐他汀通过干扰甲羟戊酸途径,间接抑制GPX4功能。
天然产物的多靶点智慧
◆ 隐丹参酮通过结合铁蛋白,促进铁离子释放[9]。
◆ 重楼皂苷III通过ACSL4介导增强脂质过氧化。
◆ 姜黄素和18-β-甘草次酸等也显示出诱导铁死亡的潜力。
纳米技术的精准递送革命
为解决铁死亡诱导剂水溶性差、靶向性弱的问题,科学家设计了多种"智能纳米载体":叶酸修饰的外泌体能够精准识别乳腺癌细胞表面的叶酸受体[10],金属有机框架材料在肿瘤微酸性环境中智能释放铁离子和药物[11]。
结语
铁死亡的相关研究正在改写三阴性乳腺癌治疗的局面。这个曾被视为细胞生物学的基础研究发现,如今已成为转化医学的典范。它利用癌细胞自身的代谢特点,将维持其生存的物质转化为致命的武器。随着更多临床试验的开展和纳米递送系统的不断优化,靶向铁死亡的治疗策略将在不久的将来为治疗选择有限的三阴性乳腺癌患者,带来新的曙光。(详情请点击阅读原文)
参考文献
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA A Cancer J Clin, 2024, 74(3): 229-263
[2] Nolan E, Lindeman G J, Visvader J E. Deciphering breast cancer: from biology to the clinic. Cell, 2023, 186(8): 1708-1728
[3] Li S, Huang Y. Ferroptosis: an iron-dependent cell death form linking metabolism, diseases, immune cell and targeted therapy. Clin Transl Oncol, 2022, 24(1): 1-12
[4] Jhaveri M S, Rait A S, Chung K N, et al. Antisense oligonucleotides targeted to the human alpha folate receptor inhibit breast cancer cell growth and sensitize the cells to doxorubicin treatment. Mol Cancer Ther, 2004, 3(12): 1505-1512
[5] Li J, He D, Li S, et al. Ferroptosis: the emerging player in remodeling triple-negative breast cancer. Front Immunol, 2023, 14: 1284057
[6] Li F J, Long H Z, Zhou Z W, et al. System xc-/GSH/GPX4axis: an important antioxidant system for the ferroptosis in drug-resistant solid tumor therapy. Front Pharmacol, 2022, 13: 910292
[7] Lee J, Roh J L. Targeting GPX4 in human cancer: implications of ferroptosis induction for tackling cancer resilience. Cancer Lett, 2023, 559: 216119
[8] Sui S, Xu S, Pang D. Emerging role of ferroptosis in breast cancer: New dawn for overcoming tumor progression. Pharmacol Ther, 2022,232: 107992
[9]闫莉.隐丹参酮通过铁死亡抑制三阴性乳腺癌的机制研究[D].上海:中国人民解放军海军军医大学, 2021
[10] Li Z, Wu X, Wang W, et al. Fe(II) and tannic acid-cloaked MOF as carrier of artemisinin for supply of ferrous ions to enhance treatment of triple-negative breast cancer. Nanoscale Res Lett, 2021, 16(1): 37
[11] Zhu J, Dai P, Liu F, et al. Upconverting nanocarriers enable triggered microtubule inhibition and concurrent ferroptosis induction for selective treatment of triple-negative breast cancer. Nano Lett, 2020, 20(9): 6235-6245
作者简介
王 君:三峡大学第二人民医院硕士生导师,研究方向为药物靶点发掘与分子药理学。
王鑫蝶:三峡大学基础医学院硕士研究生,研究方向为药物靶点发掘与分子药理学。
(作者:王君、王鑫蝶)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: