
线粒体:身体的“能量工厂”,也是健康的守护者
微观的奇迹
线粒体是什么
在我们身体的每个细胞里,都藏着数百到上千个"小发电厂"--它们的名字叫线粒体。当你跑步、思考、甚至只是眨眼时,这些微小的"发电厂"正在日夜不停地工作,把食物中的糖和脂肪转化为能量通货--三磷酸腺苷(ATP),它是能量的储存和交换形式。可以说,线粒体是维持生命活力的能量源泉--它让心脏跳动、大脑思考、肌肉运动。如果线粒体出现故障,身体的"电力系统"就会紊乱,各种代谢问题便接踵而至。
科学家们发现,肥胖、糖尿病、脂肪肝等代谢性疾病的背后,往往都能看到线粒体功能障碍的影子。
线粒体的"质检部门"
它如何保持健康?
一座工厂要长期运转,必须有一套完善的"质检系统",线粒体也不例外。在细胞中,有一整套叫做线粒体质量控制系统的机制,负责修复、更新甚至清除受损的线粒体。这套系统包括以下四个主要部分。
01 线粒体生物合成:造"新厂房"的工程队
当能量需求增加(比如运动时),细胞会"扩建发电厂",制造出更多新的线粒体。主导这个过程的关键"调度员"叫过氧化物酶体增殖物激活受体共激活因子1α(PGC1α)。它能启动一系列基因,让细胞制造新的线粒体、增强能量供应。
02 线粒体动力学:工厂的"伸缩结构"
线粒体并不是静止的,而是处于不断"融合"和"分裂"的动态平衡。融合就像"合并生产线",提高产能效率;分裂则是"拆分设备",清除硬件故障。这种动态平衡由一组"动力蛋白"维持,例如动力相关蛋白1(DRP1)(分裂)、视神经萎缩蛋白1(OPA1)(融合)、线粒体融合蛋白1/2(MFN1/2)(融合)。如果平衡被打破,线粒体就会"断裂"或"臃肿",功能也会随之受损。
03 线粒体蛋白质修复系统:工厂里的"维修员"
线粒体中有上千种蛋白质,任何一个出错都可能导致"生产事故"。像线粒体ATP依赖性蛋白酶Lon蛋白酶1(LONP1)、ClpXP蛋白酶(ClpXP)这样的蛋白酶就是维修清理人员,专门清理未折叠、错误折叠或受损的蛋白质,保持线粒体内部整洁有序。
04 线粒体自噬:老旧工厂的"回收方案"
当某些线粒体彻底损坏时,细胞会通过一种叫线粒体自噬的方式,将它们分解再利用。这一经典途径由磷酸酶和张力蛋白同源激酶1(PINK1)与Parkin两个蛋白质协调完成。这样既能防止"老旧厂"污染环境,也能节省能量。
这四个环节共同维持线粒体的"青春"和运作效率,是细胞健康代谢的关键保障。
糖与脂肪的故事
线粒体如何影响代谢
糖代谢:线粒体让血糖稳定运行
线粒体是糖代谢的核心"引擎"。当我们吃下碳水化合物,葡萄糖进入细胞后经糖酵解生成丙酮酸,进入线粒体三羧酸循环进行"燃烧"以释放能量。同时,线粒体的功能还直接决定胰岛β细胞是否能分泌足够的胰岛素。如果线粒体出现问题,胰岛素分泌不足或组织对胰岛素反应不敏感,就会出现胰岛素抵抗,这是糖尿病的根源之一。
研究显示,PGC1α可以增加肌肉中葡萄糖转运蛋白4(GLUT4)的表达,让血糖更快被组织利用[1];OPA1缺乏则让细胞的能量工厂"断电",胰岛素分泌能力大减[2]。
脂代谢:脂肪"内燃机"
线粒体不仅"烧糖",还负责"烧脂"。它通过一种叫脂肪酸β氧化的过程,分解脂肪产生能量。关键调节因子PGC1α能打开脂肪燃烧开关,激活肉毒碱脂酰转移酶1(CPT1)和过氧化物酶体增殖物激活受体α(PPARα),加快脂肪分解[3]。反之,线粒体受损会让脂肪无法完全燃烧,囤积在肝脏和血液中,导致肥胖、脂肪肝和血脂异常。
线粒体自噬也能参与调节脂肪代谢。比如:BCL2/腺病毒E1B19kDa相互作用蛋白3(BNIP3)的缺乏会引发脂肪细胞炎症和胰岛素抵抗[4]。可以说,线粒体是脂肪代谢的"节拍器",决定身体是"燃烧"还是"囤积"。
当线粒体"罢工"
三大代谢病的背后推手
非酒精性脂肪性肝病(NAFLD)
在脂肪肝患者的肝细胞中,线粒体常常"肿胀、断裂",失去活力。这意味着脂肪燃烧功能下降,未被消耗的脂肪只能在肝脏堆积。更糟糕的是,损坏的线粒体释放的活性氧类(ROS)会引起炎症,进一步损伤肝细胞。研究发现,调节线粒体自噬(如激活PINK1/Parkin通路)能显著改善高脂饮食小鼠的肥胖和肝脂肪变性[5]。
Ⅱ型糖尿病(T2DM)
糖尿病的核心是胰岛素分泌障碍与胰岛素抵抗。这些几乎都与线粒体状态密切相关。胰岛β细胞中的线粒体转录因子A(TFAM)的缺失,会导致胰岛素分泌减少和葡萄糖不耐受[6]。有研究发现,胰岛β细胞中LONP1蛋白酶的缺失会导致线粒体蛋白异常折叠和呼吸功能下降,蛋白质稳态受损从而引发β细胞凋亡和高血糖[7]。
肥胖与代谢综合征
肥胖并不只是"吃得多",更重要的原因之一是能量没被正确利用。在肥胖人群中,白色脂肪(储存能量)组织的线粒体数量和功能显著下降。相反,棕色脂肪(专门"烧脂产热")组织的线粒体最活跃,它们能把多余能量直接变成热量。因此,增加棕色脂肪或"唤醒"米色脂肪(白脂肪的中间形态),已成为抗肥胖的新方向。
抗病毒
线粒体的隐藏技能
除了调控代谢,线粒体其实也是人体抗病毒的重要"指挥部"。当病毒侵入细胞时,线粒体会立即参与防御。
线粒体如何识别病毒?
流感病毒侵入细胞后会释放病毒RNA,细胞"侦察兵"视黄酸诱导基因1(RIG-1)发现后,会把这个信号传递给线粒体外膜上的关键蛋白质--线粒体抗病毒信号蛋白(MAVS)。它就像一个"防空警报系统",启动Ⅰ型干扰素产生、抗病毒基因表达、免疫细胞招募并抑制病毒复制[8]。因此,线粒体决定抗病毒反应是否迅速有效。
流感病毒如何反击?
目前流感进入快速上升期,甲型H3N2成主流行毒株。流感病毒为防止被消灭,它会反向攻击线粒体。流感病毒的NS1蛋白可以抑制RIG-1表达、阻断MAVS信号、降低干扰素产生、促进DRP1表达使线粒体碎裂并抑制线粒体能量供应。也就是说,病毒会切断"警报系统"。
为什么有些人感染流感更严重?
部分患者线粒体本身比较"虚弱":肥胖、糖尿病、脂肪肝、熬夜、压力过大、缺乏运动、老年人。这些情况会让线粒体功能受损,更易受病毒的攻击。
科学家在努力
修复线粒体,重启健康
线粒体的损坏曾被认为是不可逆的"衰老标志",但近年来研究发现,它其实可以被修复。科学家们正通过以下几种方式"重塑"线粒体功能:(详情请点击阅读原文)
01 促进线粒体再生
人工合成化合物如ZLN005能激活PGC1α,刺激新线粒体生成[9]。中药方剂如葛根芩连汤也被证明能减少小鼠NAFLD进展中的脂质积累,增强线粒体的生物发生并促进线粒体的融合[10]。这些研究发现提示,促进线粒体再生,为细胞代谢"再造金身"是维护自身健康的重要措施。
02 调控线粒体动力学
相关研究发现,药物Mdivi-1可抑制DRP1过度分裂,减少脂肪肝炎症[11];羟基酪醇(橄榄油中的天然抗氧化物)能改善线粒体形态,提升胰岛素敏感性[12]。提示维持线粒体的融合/分裂平衡对于抵抗代谢疾病至关重要。
03 激活线粒体自噬
糖尿病药物二甲双胍不仅降血糖,还能促进线粒体自噬,让细胞清理损伤部分并恢复活力[13];达格列净可通过上调线粒体自噬的关键调节因子改善线粒体质量控制,最终改善小鼠的胰岛素抵抗情况[14]。
04 维持线粒体蛋白质修复系统
研究人员发现,含有高脂肪和高果糖的饮食常诱发非酒精性脂肪性肝炎(NASH),这与肝脏线粒体功能障碍有明确的关系。为高糖高脂饮食的小鼠肝脏补充线粒体基质酪蛋白水解蛋白酶P(ClpP)可以明显改善NASH症状[15]。研究结果提示,维持线粒体蛋白修复系统的稳定有助于修复线粒体功能,对抗疾病进展。
结语
保护"细胞发电厂",从改变生活习惯开始
线粒体不是遥远的分子名词,而是我们健康的根基。它们在每一次呼吸、每一滴汗水、每一次心跳中默默工作。想让线粒体保持旺盛活力,其实并不难--多运动。规律运动:能直接刺激线粒体新生;均衡饮食:避免高脂高糖饮食,给线粒体减负;规律作息:良好的睡眠有助于修复线粒体;减压:慢性压力会破坏线粒体膜电位,降低效率。
健康,从细胞开始。而细胞的活力,就藏在每一个闪烁着微光的线粒体里。
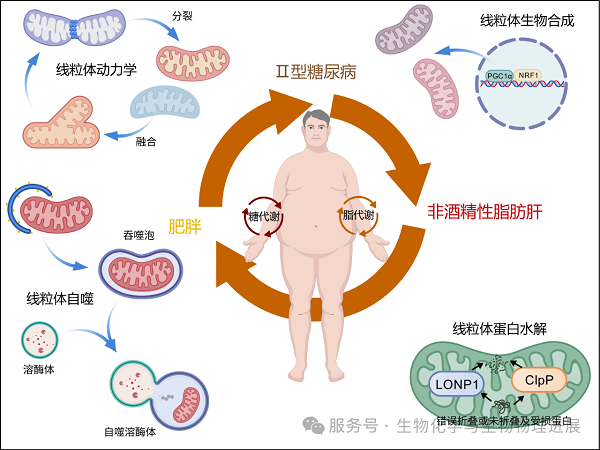
线粒体质量控制在糖脂代谢和代谢性疾病中的作用
参考文献
1. Norton L, Shannon C, Gastaldelli A, et al. Insulin: the master regulator of glucose metabolism. Metabolism, 2022, 129: 155142
2. Chen H, Chomyn A, Chan D C. Disruption of fusion results in mitochondrial heterogeneity and dysfunction. J Biol Chem, 2005, 280(28): 26185-26192
3. Vega R B, Huss J M, Kelly D P. The coactivator PGC-1 cooperates with peroxisome proliferator-activated receptor alpha in transcriptional control of nuclear genes encoding mitochondrial fatty acid oxidation enzymes. Mol Cell Biol, 2000, 20(5): 1868-1876
4. Tol M J, Ottenhoff R, van Eijk M, et al. A PPARγ-Bnip3 axis couples adipose mitochondrial fusion-fission balance to systemic insulin sensitivity. Diabetes, 2016, 65(9): 2591-2605
5. Wang S, Tao J, Chen H, et al. Ablation of Akt2 and AMPK α 2 rescues high fat diet-induced obesity and hepatic steatosis through Parkin-mediated mitophagy. Acta Pharm Sin B, 2021, 11(11): 3508-3526
6. Silva J P, Köhle M, Graff C, et al. Impaired insulin secretion and β-cell loss in tissue-specific knockout mice with mitochondrial diabetes. Nat Genet, 2000, 26(3): 336-340
7. Li J, Deng Y, Gasser M, et al. LONP1 regulation of mitochondrial protein folding provides insight into beta cell failure in type 2 diabetes. Nat Metab, 2025, 7(8): 1570-1592
8. Dhir A, Dhir S, Borowski L S, et al. Mitochondrial double-stranded RNA triggers antiviral signalling in humans. Nature, 2018, 560(7717): 238-242
9. Yang J, Shi X, Ma M, et al. PGC-1α role in rescuing ferroptosis in cerebral ischemia/reperfusion injury through promoting mitochondrial biogenesis and UCP2 expression. Biochim Biophys Acta Mol Basis Dis, 2025, 1871(6): 167874
10. Wang C H, Liu H M, Chang Z Y, et al. Antioxidants rich herbal formula ger-gen-chyn-Lian-Tang protects lipotoxicity and ameliorates inflammation signaling through regulation of mitochondrial biogenesis and mitophagy in nonalcoholic fatty liver disease mice. Front Biosci (Landmark Ed), 2022, 27(8): 242
11. Elbadawy M, Tanabe K, Yamamoto H, et al. Evaluation of the efficacy of mitochondrial fission inhibitor (Mdivi-1) using non-alcoholic steatohepatitis (NASH) liver organoids. Front Pharmacol, 2023, 14: 1243258
12. Cao K, Xu J, Zou X, et al. Hydroxytyrosol prevents diet-induced metabolic syndrome and attenuates mitochondrial abnormalities in obese mice. Free Radic Biol Med, 2014, 67: 396-407
13. de Marañón A M, Díaz-Pozo P, Canet F, et al. Metformin modulates mitochondrial function and mitophagy in peripheral blood mononuclear cells from type 2 diabetic patients. Redox Biol, 2022, 53: 102342
14. Zhang L, Lin H, Yang X, et al. Effects of dapagliflozin monotherapy and combined aerobic exercise on skeletal muscle mitochondrial quality control and insulin resistance in type 2 diabetes mellitus rats. Biomed Pharmacother, 2023, 169: 115852
15. Choi S E, Hwang Y, Lee S J, et al. Mitochondrial protease ClpP supplementation ameliorates diet-induced NASH in mice. J Hepatol, 2022, 77(3): 735-747
作者简介
周炜潜,南华大学基础医学院基础医学博士生,研究方向为线粒体稳态与人类重大疾病。
谭智杰,南华大学基础医学院基础医学博士生,研究方向为线粒体质量控制与人类重大疾病。
吕 斌,南华大学衡阳医学院研究员,博士生导师,研究方向:线粒体蛋白稳态调控与人类疾病。
(作者:周炜潜、谭智杰、吕斌)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: