
吃对“量”,保“好”心
凌晨3点的重症医学病房(ICU),监护仪的刺耳警报打破寂静。65岁的脓毒症患者张先生血压骤降,超声心动图显示,他的心脏射血分数(EF值)从入院时的65%暴跌至35%,心肌酶谱全面飘红。主治医生陷入两难:患者正处于高分解代谢状态,指南推荐早期积极营养支持;但过量喂养可能加重炎症反应,让本就受损的心脏雪上加霜。这道"补与限" 的难题,正是脓毒症心肌病治疗中的核心困境,而答案或许藏在"科学限热"里。
脓毒症心肌病:感染引发的"心脏危机"
脓毒症,通俗说就是身体遭遇感染后,免疫系统"防卫过当"引发的危及生命的器官损伤。而心脏,作为全身血液循环的"核心泵",是这场"免疫风暴"中最易受创的器官。由脓毒症诱发的心肌功能障碍,就是脓毒症心肌病,它的死亡率高达70%~90%,是脓毒症患者死亡的主要原因之一[1-2]。脓毒症心肌病的机制复杂多样,病理生理过程尚未完全阐明(图1),目前主要认为和炎症级联反应诱导的心肌损伤、线粒体功能障碍密切相关[3]。
炎症风暴的直接攻击
感染后,病原体释放的有害物质会与心肌细胞表面的"识别受体"(TLR4)结合,就像打开了炎症反应的"潘多拉魔盒"。这会激活体内多条关键炎症通路(如NF-κB、NLRP3炎症小体),促使白介素- 6(IL-6)、肿瘤坏死因子-α(TNF-α)等促炎因子"海量释放"。这些因子不仅直接损伤心肌细胞,还会放大炎症反应,形成"越炎越伤、越伤越炎"的恶性循环[4-5]。
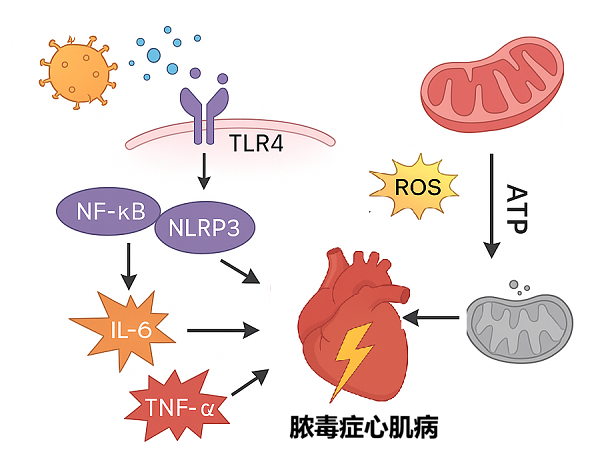
图1 脓毒症心肌病的病理机制
线粒体的能量危机
心肌细胞的"能量工厂"是线粒体,心脏跳动所需的能量(ATP)几乎全靠它生产,而脓毒症会让线粒体彻底"罢工"[6]。如炎症和氧化应激直接破坏线粒体膜的完整性,阻碍能量生成,导致心肌"动力不足";线粒体功能失调会引发活性氧类(ROS)堆积,就像 "自由基炸弹",进一步损伤线粒体DNA和结构;受损的线粒体本应被身体"清理回收"(即线粒体自噬),但脓毒症会抑制这一过程,让坏线粒体持续堆积,最终诱发心肌细胞凋亡[7-8]。
热量限制:不是挨饿,是激活"护心开关"
提到"热量限制",很多人会误以为是"节食挨饿",但这里的热量限制(CR)是一种科学的饮食方案:在保证蛋白质、维生素、矿物质等必需营养不缺的前提下,将每日热量摄入减少25%~50%(图2),热量限制核心是"精准减热量,而非减营养",与单纯饥饿有着本质区别[9]。

图2 热量限制图
这种饮食调整之所以能对抗脓毒症心肌病,关键在于激活了一个"护心核心"--沉默信息调节因子3(SIRT3)。SIRT3是"长寿蛋白家族"(Sirtuins)的重要成员,主要定居在线粒体内,就像一位"线粒体守护神"[10],通过"去乙酰化修饰"调控多种蛋白质活性,是心血管疾病的关键治疗靶点。热量限制正是SIRT3的"激活密码",一旦启动,就会通过两大路径为心脏"止损"。
给炎症风暴"踩刹车"
激活后的SIRT3会通过修饰炎症通路的关键分子(如NF-κB),抑制其进入细胞核发挥作用;同时减少心肌细胞表面识别受体(TLR4)的功能,从源头阻断炎症信号的传递。这就像给失控的免疫系统装上"刹车",减少促炎因子释放,避免心肌细胞被过度攻击[11]。
修复"能量工厂"线粒体
SIRT3对线粒体的修复堪称"全方位":激活抗氧化系统(SIRT3/SOD2信号通路),促进活性氧类(ROS)的清除,减少其对线粒体的损伤;激活视神经萎缩蛋1(OPA1),增强线粒体的融合能力,维持线粒体网络结构完整,让"能量工厂"正常运转;修饰Ku70 蛋白,使其能"捕获"促凋亡蛋白(Bax),阻止其攻击线粒体膜,避免细胞色素c等"凋亡信号"释放,从而抑制心肌细胞凋亡[12]。
简单来说,热量限制就像给心脏的"防御系统"升级:一边阻断炎症攻击,一边修复能量供应,双管齐下改善心肌功能。
近期,山东第二医科大学的研究证实:小鼠进行6周热量限制预适应后,脓毒症小鼠的心肌损伤标志物(如CK-MB、CTnI)显著下降,心功能(EF值、FS值)明显改善(图3)。(详情请点击阅读原文)
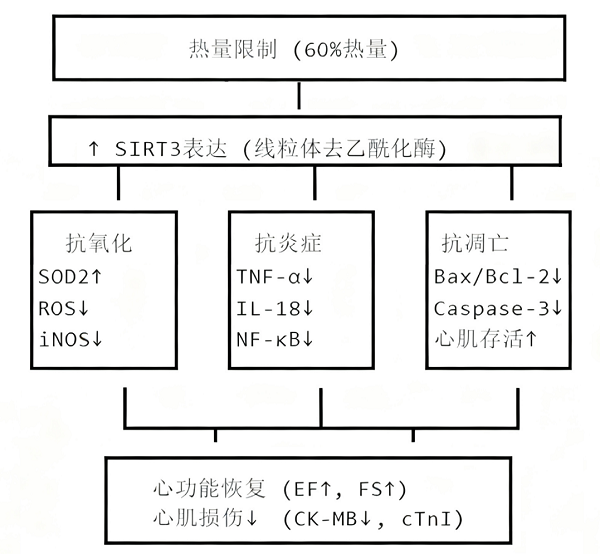
图3 6周热量限制通过调控SIRT3改善脂多糖引起的脓毒症心肌病
未来曙光:从实验室到病床的精准护心
目前,热量限制治疗脓毒症心肌病的机制已在动物实验中得到明确验证,而临床转化也正朝着更精准、更便捷的方向推进,未来可期。
个体化方案精准落地:热量限制不是"一刀切"的方案。未来会通过"明确适用人群+建立监测机制+保障营养均衡"的模式,为患者量身定制方案:比如身体质量指数(BMI)≥20 kg/m?、无营养不良的患者可适当限制饮食,而体重过轻或已存在营养缺乏的患者则需避免;同时通过定期检测心功能、炎症指标和营养状态,确保治疗安全有效[13]。
靶向SIRT3的药物研发:不想刻意限制饮食?未来或许能通过药物实现"热量限制模拟效应"。目前已发现白藜芦醇、二甲双胍等"热量限制模拟物",它们能直接上调SIRT3活性,无需节食就能发挥抗炎、修复线粒体的护心作用,为无法坚持饮食调整的患者提供新选择[14-15]。
生物标志物助力疗效预测:未来,血液中的循环SIRT3水平可能成为"疗效预测指标":通过检测这一指标,医生能提前判断患者是否适合热量限制治疗,以及治疗后可能的获益程度,让治疗更具针对性[16]。
智能营养系统实时调控:结合人工智能算法与可穿戴设备,未来能实时监测患者的代谢率、心功能参数,自动调整营养配方的热量和营养素比例,误差率可控制在5%以内,真正实现"动态精准喂养"。
结 语:饮食里的护心智慧
脓毒症心肌病虽凶险,但热量限制为我们提供了一种安全、无创的治疗新思路-无需依赖特效药物,通过科学调整饮食,就能激活身体自身的"护心机制"。这一研究不仅为 ICU 医生提供了新的治疗方向,也给普通人带来启示:饮食的核心是"适量"而非"过量",科学的饮食模式本身就是最好的健康防护。未来,随着个体化方案的优化、靶向药物的研发,脓毒症心肌病的治疗将不再局限于药物和手术,或许在日常的每一餐中,就能实现对心脏的守护。
愿这份"吃出来的护心方案",能为更多危重患者带来希望,也让我们重新认识饮食与健康的紧密关联--吃对 "量",才能护好 "心"。
参考文献:
[1] Zhu H, Zhang L, Jia H, et al. Tetrahydrocurcumin improves lipopolysaccharide-induced myocardial dysfunction by inhibiting oxidative stress and inflammation via JNK/ERK signaling pathway regulation. Phytomedicine, 2022, 104: 154283
[2] Tucker R V, Williams K, Theyyunni N, et al. Sepsis-induced cardiomyopathy detected with focused cardiac ultrasound in the emergency department. J Emerg Med, 2022, 63(4): e91-e99
[3] Jiang Y, Li Y, Zhang Y, et al. NSC228155 alleviates septic cardiomyopathy via protecting mitochondria and inhibiting inflammation. Int Immunopharmacol, 2023, 116: 109847
[4] Xing X R, Luo L P, Li Y L, et al. Role of activating the nuclear factor kappa B signaling pathway in the development of septic cardiomyopathy in rats with sepsis. Technol Health Care, 2023, 31(5): 1671-1681
[5] Yang W, Zhao A, Lei W, et al. Pleiotropic role of TNIK in sepsis-induced cardiomyopathy. J Cell Physiol, 2025, 240(4): e70027
[6] de Sousa A A P, da Silva Chaves L, Facundo H T. Mitochondrial electron transport chain disruption and oxidative stress in lipopolysaccharide-induced cardiac dysfunction in rats and mice. Free Radic Res, 2025, 59(5): 377-391
[7] Hu D, Sheeja Prabhakaran H, Zhang Y Y, et al. Mitochondrial dysfunction in sepsis: mechanisms and therapeutic perspectives. Crit Care, 2024, 28(1): 292
[8] Gao L, Shi Q, Sun B, et al. C-FLIP protects cardiac microcirculation in sepsis-induced myocardial dysfunction via FUNDC1-mediated regulation of mitochondrial autophagy. JACC Basic Transl Sci, 2025, 10(8): 101257
[9] Napole?o A, Fernandes L, Miranda C, et al. Effects of calorie restriction on health span and insulin resistance: classic calorie restriction diet vs. ketosis-inducing diet. Nutrients, 2021, 13(4): 1302
[10] Xin T, Lu C. SirT3 activates AMPK-related mitochondrial biogenesis and ameliorates sepsis-induced myocardial injury. Aging (Albany NY), 2020, 12(16): 16224-16237
[11] Ahuja A, Kim E, Sung G H, et al. STAT3 differentially regulates TLR4-mediated inflammatory responses in early or late phases. Int J Mol Sci, 2020, 21(20): 7675
[12] Yang J T, Jiang C Y, Zhang Z Y, et al. Luteolin reduces necroptosis in the diabetic heart after cardiac arrest and resuscitation by activating sirtuin 3. Front Nutr, 2025, 12: 1626020
[13] Bianchi V E. Caloric restriction in heart failure: a systematic review. Clin Nutr ESPEN, 2020, 38: 50-60
[14] Zhu X, Ma E, Ge Y, et al. Resveratrol protects against myocardial ischemic injury in obese mice via activating SIRT3/FOXO3a signaling pathway and restoring redox homeostasis. Biomed Pharmacother, 2024, 174: 116476
[15] Sun D, Yang F. Metformin improves cardiac function in mice with heart failure after myocardial infarction by regulating mitochondrial energy metabolism. Biochem Biophys Res Commun, 2017, 486(2): 329-335
[16] Gupta N, Kumar V, Kanwal A. SIRT3 as a potential biomarker and therapeutic target for cardiovascular diseases: a meta-analysis of clinical studies. Future Cardiol, 2025, 21(10): 779-788
作者简介:
陆 浩:山东第二医科大学康复医学院硕士生;研究方向:心血管疾病的营养干预。
孙忠广:山东第二医科大学康复医学院教师;研究领域:心血管疾病的运动干预和营养干预机制。
(作者:陆浩、孙忠广)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: