
运动如何“解冻”帕金森病?
帕金森病是一种常见的神经退行性疾病,被称为"沉默的冰冻人",全球约有1000万患者,患者常面临手脚震颤、肌肉僵直、动作迟缓甚至平衡障碍等难题[1]。长期以来,医学界认为它的核心病因是大脑中产生多巴胺的神经元死亡[2],因此药物治疗(如左旋多巴)主要围绕补充多巴胺展开。然而,近年来研究发现,运动对帕金森病的改善效果远超预期,许多坚持锻炼的患者症状明显减轻,甚至能延缓疾病进展。
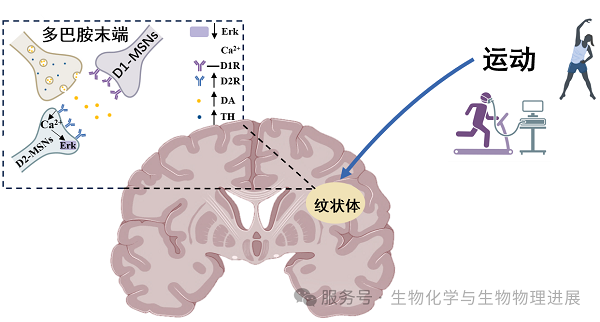
中等多棘神经元(MSNs)是纹状体内的主要神经元,其中表达多巴胺2型受体的MSNs的功能异常与帕金森病的运动障碍密切相关。这些神经元就像交通指挥中心,通过纹状体胞外信号调节激酶/促分裂原活化的蛋白质激酶(Erk/MAPK)信号通路调控着身体的运动指令。当这个信号系统出现紊乱时,就会影响纹状体D2型中等多棘神经元(D2-MSNs)的功能活动,引发基底神经节运动功能调节障碍[3]。因此大脑"运动调度员"--纹状体D2型中等多棘神经元的功能失调才是关键"幕后黑手"。
意外发现
Erk1/2水平升高,运动能力反而下降?
在帕金森病小鼠研究中发现了一个重要线索:运动可能通过调节大脑纹状体中D2-MSNs的Erk/MAPK信号通路来发挥治疗作用。这个通路就像神经元生存和适应能力的"调控开关"--运动不仅能提高这些神经元的存活率,还能增强它们的可塑性。特别值得注意的是,有氧运动还能阻止一个令人头疼的治疗副作用:当帕金森病患者长期使用左旋多巴药物时,经常会出现运动障碍加重的情况[4]。而研究发现,运动就像"刹车"一样,能有效抑制纹状体Erk/MAPK信号通路的过度激活,从而缓解这个问题。
实验观察到的现象非常直观:患病的"帕金森小鼠"大脑中Erk1/2及其活性形式p-Erk1/2水平明显升高,这些小鼠表现出典型的运动症状:动作变慢、走路不稳,经过一段时间的跑步锻炼后,Erk1/2水平下降,运动能力显著改善[5]。这些发现给我们一个重要启示:Erk1/2的异常激活很可能是导致帕金森病运动障碍的"罪魁祸首",而规律运动则能够重新校准这个失调的信号系统。这不仅解释了运动为何能改善帕金森症状,也为开发新的治疗方法提供了科学依据。
关键突破
D2-MSNs是运动的"核心靶点"
为了更清楚地了解Erk1/2在帕金森病中的作用,研究人员使用了先进的光遗传学技术,就像用"光控开关"一样精准调控大脑中两种关键神经元--D1-MSNs和D2-MSNs的活性。实验发现了一个有趣的现象:当抑制D2-MSNs神经元中的Erk1/2信号时,小鼠的运动障碍明显改善;而调控D1-MSNs神经元则没有明显效果[6]。
进一步研究发现,在帕金森病小鼠的大脑中,异常的Erk/MAPK信号就像"错误的警报"一样,主要集中在D2-MSNs神经元上[7-8]。研究人员让这些小鼠进行了为期4周的"跑步锻炼",结果发现,运动就像"关掉了警报器",有效抑制了D2-MSNs上的Erk/MAPK信号通路,从而显著改善了运动功能障碍[5-6,9]。这些发现告诉我们,在大脑复杂的神经网络中,D2-MSNs(而不是它的"邻居"D1-MSNs)才是运动改善帕金森症状的关键所在。这就像找到了控制运动功能的"主开关",为未来开发更精准的治疗方法提供了重要线索。(详情请点击阅读原文)
精准干预
降低Erk1/2水平,运动效果更佳
为了验证这一机制,研究人员采用了更精准的化学遗传学方法,向患有帕金森病的小鼠大脑中负责运动调控的D2-MSNs神经元注射了一种特殊病毒,这种病毒能够降低神经元中Erk1/2的含量。实验结果显示:随着Erk1/2及其活性形式p-Erk1/2水平的下降,小鼠的运动能力明显改善;更有趣的是,当这些经过基因干预的小鼠再进行有氧运动训练后,Erk1/2水平进一步降低,运动能力的恢复效果也更加显著。这一系列研究告诉我们三个重要发现:
1)D2-MSNs神经元中过度活跃的Erk1/2蛋白确实是导致帕金森病运动障碍的"坏分子"之一;
2)运动锻炼能通过抑制Erk1/2的活性来帮助恢复运动功能;
3)将基因干预和运动训练相结合的治疗方案,可能比单独使用其中任何一种方法都更有效。
这个发现不仅揭示了帕金森病运动障碍的新机制,也为开发"基因+运动"的联合治疗方案提供了科学依据。
科学意义
为帕金森病治疗提供新思路
河北师范大学陈巍团队的研究[5-6]揭示:Erk1/2在D2-MSNs中的异常激活是帕金森病运动障碍的关键因素;运动通过下调Erk1/2来改善症状,D2-MSNs是运动疗法的核心靶点,未来可开发精准干预策略。这一发现挑战了以往"运动普遍激活神经信号"的假设,并提示:过度活跃的Erk1/2可能损害D2-MSNs功能,而运动能"重置"这一异常;未来可研发靶向D2-MSNs Erk1/2的药物或基因疗法,与运动协同治疗。(详情请点击阅读原文)
未来展望
从实验室到临床应用
基于这些突破性发现,未来研究可探索:
精准医疗新可能
未来或许可以通过简单的血液检测或脑部扫描,就能测量患者体内的Erk1/2水平。可根据检测结果为每位帕金森患者定制最适合的运动处方--包括运动类型、强度和时间。
靶向药物研发
研究人员正在探索能否开发一种"智能药物",它能像精准的"分子开关"一样,专门调节D2-MSNs神经元中的Erk1/2活性,而不影响其他脑区。这种靶向治疗可能会减少副作用,提高疗效。
无创增强疗法
另一个有趣的方向是结合非侵入性脑刺激技术,比如经颅磁刺激(TMS)。想象一下,患者在跑步机上锻炼的同时接受磁刺激,就像给大脑做"运动加速器",可能会产生1+1>2的治疗效果。
这些前沿探索不仅可能改变帕金森病的治疗模式,也为其他运动障碍疾病的研究开辟了新思路。
结语
运动,让大脑"回归正轨"
虽然帕金森病目前仍是医学界尚未攻克的难题,但研究发现,规律运动能够调节大脑D2神经元中失调的Erk1/2信号通路,帮助重建运动控制系统。无论是清晨散步、水中畅游,还是刚柔并济的太极拳,这些看似简单的运动都在悄悄重塑着大脑的神经网络。
这些研究不仅解释了为什么运动能改善帕金森症状,更为重要的是,它为开发新一代靶向治疗方法指明了方向。运动,这个人类最古老的健康秘诀,正在现代科学的解读下展现出全新的医学价值。对于帕金森病患者来说,坚持锻炼不再只是保健建议,而是有科学依据的重要治疗手段。
参考文献
[1] Su Y,Deng M F,Xiong W,et al. microRNA-26a/death-associated protein kinase 1 signaling induces synucleinopathy and dopaminergic neuron degeneration in Parkinson's disease. Biol Psychiatry,2019,85(9):769-781
[2] 陈平,刘晓莉,马婧,等. PD模型大鼠纹状体中等多棘神经元树突棘运动依赖可塑性研究. 体育科学,2020,40(12):54-62
[3] Hutton S R,Otis J M,Kim E M,et al. ERK/MAPK signaling is required for pathway-specific striatal motor functions. J Neurosci,2017,37(34):8102-8115
[4] Zhou F,Wei L,Wang Y,et al. Aerobic exercise modulates the striatal Erk/MAPK signaling pathway and improves LID in a mouse model of Parkinson's disease. Brain Res Bull,2024,209: 110906
[5] Wang X,Wang Y,Chen J,et al. Aerobic exercise improves motor function and striatal MSNs-Erk/MAPK signaling in mice with 6-OHDA-induced Parkinson's disease. Exp Brain Res,2022,240(6):1713-1725
[6] Wang Y,Wei L,Tan M,et al. Aerobic exercise improves motor dysfunction in Parkinson's model mice via differential regulation of striatal medium spiny neuron. Sci Rep,2024,14(1):12132
[7] Cai L,Tu L,Yang X,et al.RETRACTED: HOTAIR accelerates dyskinesia in a MPTP-lesioned mouse model of PD via SSTR1 methylation-mediated ERK1/2 axis. Mol Ther Nucleic Acids,2020,22: 140-152
[8] Bono F,Tomasoni Z,Mutti V,et al. G protein-dependent activation of the PKA-Erk1/2 pathway by the striatal dopamine D1/D3 receptor heteromer involves beta-arrestin and the tyrosine phosphatase shp-2. Biomolecules,2023,13(3):473
[9] 王寅昊,檀明利,陈巍. Erk/MAPK信号通路对基底神经节运动控制作用的差异调控. 中国生物化学与分子生物学报,2023,39(6):789-797
作者简介
高博:河北师范大学体育学院运动人体科学专业硕士研究生,研究方向为运动与神经可塑性。
葛一彤:河北师范大学体育学院运动人体科学专业硕士研究生,研究方向为运动与神经可塑性。
赖一宁:河北师范大学体育学院运动人体科学专业硕士研究生,研究方向为运动与神经可塑性。
(作者:高博、葛一彤、赖一宁)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: