2020年 6月 12日,《生物化学杂志》(JBC)发表了中科院生物物理所柯莎(Sarah Perrett)研究组和陈畅研究组的合作研究论文,题为"S-Glutathionylation of human inducible Hsp70 reveals a regulatory mechanism involving the C-terminal α-helical lid"。该研究工作是柯莎研究组和陈畅研究组长期合作获得的重要成果。研究发现人源应激型Hsp70的C末端底物结合域的α螺旋盖子上的两个半胱氨酸发生谷胱甘肽化修饰后,导致其C末端α螺旋盖子发生去折叠,从而暴露Leu542,该残基与底物结合域的相互作用导致了Hsp70底物结合部位的封闭,而不能结合其底物,这一过程随去谷胱甘肽化的发生而完全可逆。研究结果揭示了Hsp70的谷胱甘肽化修饰对其结构和功能的调控机制,阐明了人源应激型Hsp70的C端结构域上的谷胱甘肽化修饰,是一种调节Hsp70底物结合能力的新机制,可能在氧化应激时调节其底物的活性,从而传递氧化还原信号。
蛋白质半胱氨酸Cys上的谷胱甘肽化修饰作为一种可逆的氧化还原修饰,一方面可以保护蛋白免于发生磺酸化(-SO3H)等不可逆的氧化损伤,另一方面和磷酸化修饰一样发挥信号转导功能,传递氧化还原信号。Hsp70是蛋白质质量控制体系中的核心分子伴侣,对于生命体稳态平衡有极为重要的意义。除极少数Hsp70之外,大部分Hsp70都有至少1个Cys。因此,深入挖掘Hsp70的氧化还原修饰机制对帮助揭示蛋白质稳态的氧化还原调控机制及拓展人们对Hsp70功能的认识具有重要意义。
该研究主要由柯莎课题组已毕业的博士生杨杰、副研究员张红和宫维斌(共同第一作者)等人完成相关实验。王磊研究员也为谷胱甘肽化修饰的细胞内检测提供了技术支持,在讨论中给予了有益的启发。柯莎研究员、陈畅研究员及张红副研究员为共同通讯作者。该研究得到了科技部国家重点研发计划、国家自然科学基金委项目的资助。
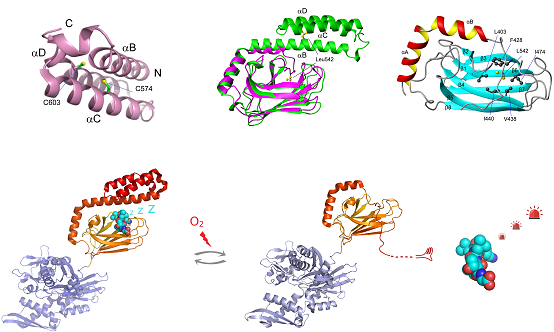
图解:人源应激型Hsp70的C末端α螺旋盖子上的半胱氨酸(上图左)在氧化应激时发生谷胱甘肽化修饰,将导致α螺旋盖子的去折叠(上图中:绿色,谷胱甘肽化修饰前;紫红色,修饰后),其Leu542占据其自身的底物结合位点(上图右)。该过程完全可逆。底物结合位点被Leu542封闭后,Hsp70释放出底物,其中包括作为氧化应激相关的信号分子,如Heat Shock Transcription Factor, HSF1。信号分子释放后,将启动下一步的应激过程(下图)。
文章链接: https://www.jbc.org/content/295/24/8302.long
(供稿:柯莎研究组)
 附件下载:
附件下载: