
赵岩研究组揭示人源葡萄糖-6-磷酸转运蛋白G6PT1的结构与抑制机制
在维持机体血糖稳态的精密调节网络中,肝脏的葡萄糖输出扮演着核心角色。葡萄糖-6-磷酸(G6P)作为糖原分解与糖异生途径的共同终末产物,其向内质网腔的跨膜转运是肝脏释放葡萄糖至血液循环的限速步骤。执行这一关键转运任务的,是内质网膜上的葡萄糖-6-磷酸转运蛋白1(G6PT1,由SLC37A4基因编码)。G6PT1的功能完整性至关重要:其功能的完全丧失会导致一种严重的常染色体隐性遗传代谢病--Ib型糖原贮积症(GSD1b),患者表现为危及生命的低血糖、肝肿大及中性粒细胞功能障碍;另一方面,在2型糖尿病中,适度且可逆地抑制G6PT1活性,可有效降低肝脏过度的葡萄糖输出,因而成为调控血糖的一个具有潜力的治疗策略。研究表明,天然化合物绿原酸(CGA)能够抑制G6PT1,在临床实验中显示出有效降低2型糖尿病患者血糖水平的作用,因此被视为一种前景广阔的潜在抗糖尿病药物。尽管其生理与病理意义重大,但G6PT1如何识别底物、磷酸如何耦合驱动G6P转运、其构象如何动态变化,以及天然抑制剂绿原酸如何实现特异性抑制等分子层面的核心机制,长期以来仍然是悬而未决的问题。
2026年1月31日,中国科学院生物物理研究所赵岩研究员团队在《Science Advances》发表题为"Structural insight into the glucose-6-phosphate transport by G6PT1 and inhibition mechanism of CGA"的研究论文。该项研究综合运用冷冻电镜单颗粒分析技术,成功解析了人源全长野生型G6PT1在多种功能状态下的高分辨率三维结构,包括无底物的内向开口构象、结合底物G6P的内向开口构象、结合共底物无机磷酸(Pi)的外向开口构象,以及与天然抑制剂绿原酸(CGA)结合的内向开口构象。这一系列结构宛如一套动态的分子"快照",首次在原子层面完整揭示了G6PT1的转运机制与抑制机理。
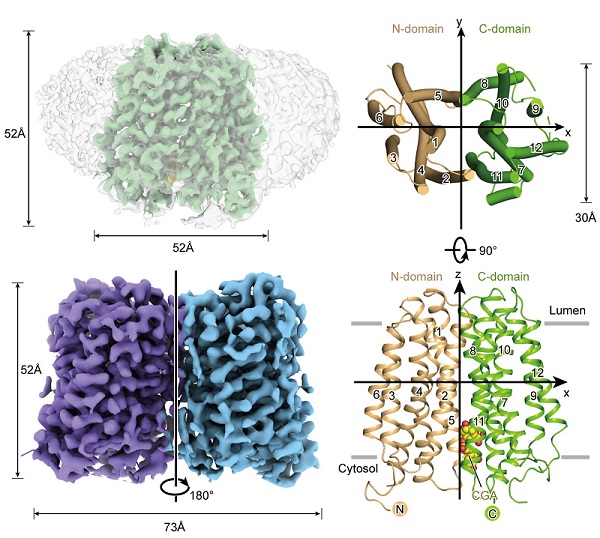
图1. G6PT1的总体结构
在底物识别方面,研究清晰地展示了带负电的G6P分子如何被包裹在一个高度正电性的中央结合口袋中,并精准鉴定出多个关键氨基酸残基。功能实验证实,这些位点的突变会严重损害甚至完全废除转运活性。尤为重要的是,临床上导致GSD1b的多个高频致病突变(如R28C/H, W118R, W138R等)正位于此结合口袋的核心区域,从结构上直接解释了其致病机理:这些突变破坏了底物结合所必需的精确化学环境。
对于G6PT1独特的磷酸耦合转运机制,该研究也提供了关键的结构见解。在结合Pi的外向开口构象中,Pi的结合位点与G6P分子的磷酸基团位置高度相似,并共享部分相同的结合残基。此外,转运过程中的构象变化也轻微改变了底物结合口袋的残基排布,有利于G6P释放到内质网中。这一发现为经典的"Pi/G6P反向交换"模型提供了直接的结构证据,表明Pi通过竞争性结合促进G6P从口袋中释放,从而驱动整个转运循环。此外,研究还通过结构分析与功能验证,揭示了在构象转换过程中稳定不同状态的关键相互作用,阐明了维持转运蛋白构象动态平衡的结构基础。
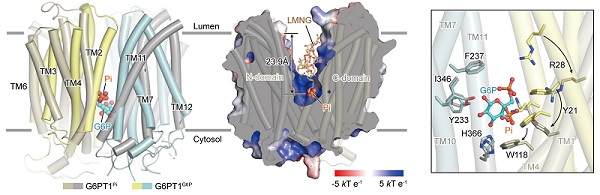
图2. G6PT1底物识别及转运机制
针对G6PT1作为糖尿病治疗靶点的巨大潜力,研究聚焦于天然小分子抑制剂绿原酸(CGA)的抑制机制。研究表明,CGA分子以一种类似于"分子楔子"的方式,结合在G6PT1的内向开口构象中。它不仅部分占据底物G6P的结合位点,实现竞争性抑制,更重要的是,其结合能显著稳定蛋白质的内向开口状态,并阻止蛋白质向外向开口转换,从而"锁死"了构象转换的路径,使转运循环停滞。此外, CGA结合的关键氨基酸在SLC37家族其他成员中并不保守,这为基于此结构设计高选择性G6PT1抑制剂效应奠定了坚实基础。
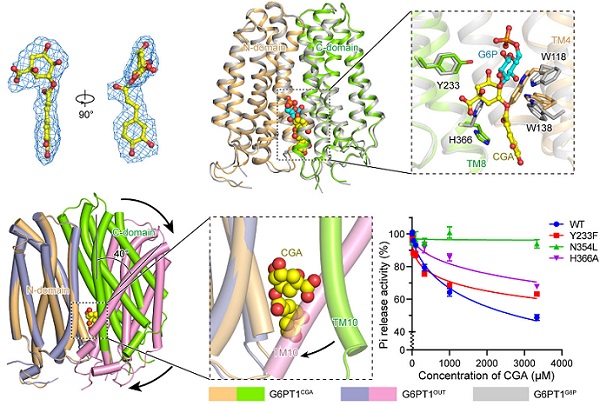
图3. CGA抑制G6PT1转运的分子机制
综上所述,该项研究系统性揭示了G6PT1的底物识别、磷酸耦合转运、构象动态变化以及绿原酸特异性抑制的分子机理。这些发现不仅将GSD1b的致病突变解释提升至精确的原子层面,加深了对这一罕见病的理解,更为重要的是,它为以G6PT1为靶点开发治疗2型糖尿病的新型药物提供了新的蓝图。基于G6PT1-CGA复合物结构进行理性药物设计,有望开发出效价更高、选择性更强、药代动力学性质更优的下一代降糖候选药物,从而推动代谢性疾病治疗领域的进步。
中国科学院生物物理研究所赵岩研究员为论文的通讯作者。生物物理所博士生陈琦浩、生物物理所与中国海洋大学联培博士生袁璞、生物物理所博士生黎仁杰为共同第一作者。此外,中国海洋大学于日磊教授、生物物理所博士生杜晓悦也为研究提供了帮助。该研究得到科技创新2030"脑科学与类脑研究"重大项目、国家重点研发计划项目、中国科学院稳定支持基础研究领域青年团队计划、国家自然科学基金项目的资助。冷冻电镜数据收集得到北京大学现代农业研究院生物微观结构研究平台的技术支持。
文章链接:
https://www.science.org/doi/10.1126/sciadv.adz8234
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202602/t20260205_1149845.shtml
(供稿:赵岩研究组)
附件下载: