
卫涛涛研究组与合作者揭示SIRT5缓解代谢功能障碍相关脂肪性肝病的分子机制
在体内外多种因素的驱动下,代谢功能障碍相关脂肪性肝病(MASLD)可发展为代谢功能障碍相关脂肪性肝炎(MASH)、肝纤维化,并最终发展为肝硬化甚至肝细胞癌(HCC),严重威胁人类健康。在MASLD疾病进展过程中,代谢紊乱会导致代谢中间产物,如丙二酰辅酶 A和琥珀酰辅酶 A蓄积;丙二酰辅酶A及琥珀酰辅酶A可作为酰基化修饰供体,共价结合于蛋白质赖氨酸残基,并对多种蛋白质,包括组蛋白、代谢酶的结构及功能造成影响。在前期研究中,中国科学院生物物理研究所卫涛涛研究组发现过表达可以下调蛋白质酰基化修饰的SIRT5能够改善基因突变引发的小鼠代谢紊乱,并在急性心肌梗死动物模型中表现出保护作用,但具体的分子机制有待揭示。
2026年1月20日,卫涛涛研究团队联合清华长庚医院周博达副主任医师团队、中国医学科学院肿瘤医院黄振主任医师团队,在《Life Medicine》发表题为"SIRT5 Mitigates Metabolic Abnormality in Murine Models of Metabolic Dysfunction-Associated Steatotic Liver Disease"的研究论文。该研究工作解析了MASLD动物模型中SIRT5通过调控蛋白质酰基化修饰,缓解慢性炎症反应、改善糖脂代谢,从而保护肝脏的作用机制。
研究团队首先通过串联质谱技术,定性定量分析了高脂饮食(HFD)喂养小鼠肝脏组织中蛋白质赖氨酸丙二酰化与琥珀酰化修饰谱。与正常饮食(ND)组相比,HFD 组中蛋白质赖氨酸丙二酰化与琥珀酰化修饰水平显著升高,生物信息学分析表明蛋白质修饰主要发生于代谢相关蛋白。通过公共数据集和单细胞RNA测序发现MASH患者肝脏中SIRT5表达水平降低,并在HFD小鼠中验证了这一发现。进一步发现E3泛素连接酶TRIM21是SIRT5的互作蛋白,在肝细胞中过表达TRIM21后,SIRT5水平降低。HFD上调肝组织中TRIM21的表达,继而促进SIRT5的降解。
在此基础上,研究团队构建肝脏特异性过表达SIRT5(Liver Sirt5 OE)的小鼠,并利用HFD诱导小鼠发生MASLD。在HFD喂养条件下,相较于对照小鼠,Liver Sirt5 OE小鼠胰岛素敏感性较高,血糖保持稳定,肝脏脂肪变性程度明显减轻;肝脏线粒体超微结构完整,脂滴蓄积减少;对肝细胞进行原位在线代谢分析,结果表明Liver Sirt5 OE小鼠的线粒体呼吸功能保持在高水平,其对葡萄糖及脂肪酸的氧化能力显著高于对照小鼠;生物信息学分析表明受SIRT5调控的酰化修饰靶蛋白主要富集于糖代谢和脂代谢通路,包括脂代谢关键酶HADHA及糖代谢关键酶CS等。鉴于慢性炎症反应是MASLD发病过程的伴生因素,研究团队进一步分析了SIRT5对炎症反应相关分子的调控作用,发现SIRT5与TBK1存在直接相互作用;免疫印迹分析表明过表达SIRT5可"擦除"TBK1的琥珀酰化修饰,下调其磷酸化,并抑制炎症细胞因子的表达及分泌,表明SIRT5还可作为慢性肝脏炎症的负调控因子发挥肝脏保护作用。
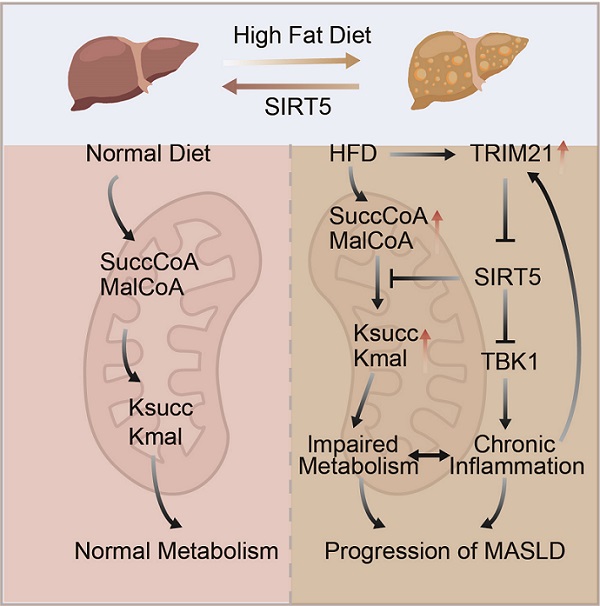
图: SIRT5缓解MASLD小鼠代谢异常及慢性炎症反应
此项研究证明了SIRT5 在MASLD进展过程中对代谢紊乱及慢性炎症反应的保护作用。在MASLD模式小鼠中,游离脂肪酸、促炎细胞因子等上调TRIM21表达,并降解SIRT5,从而导致多种代谢相关蛋白及炎症反应相关蛋白赖氨酸残基琥珀酰化与丙二酰化修饰水平升高,影响这些重要蛋白的功能;提升SIRT5水平可消除过度的蛋白质琥珀酰化与丙二酰化修饰,进而缓解糖脂代谢紊乱及慢性炎症反应。
中国科学院生物物理研究所卫涛涛研究员、北京清华长庚医院周博达副主任医师和中国医学科学院肿瘤医院黄振主任医师为该论文的共同通讯作者,卫涛涛组博士后肖敏、博士生赵军程以及北京协和医院博士生窦梓轩为共同第一作者。中国科学院生物物理研究所的杨福全研究员、王继峰博士对质谱分析提供了重要的技术支持,中国医学科学院基础医学研究所杜文静研究员、中国科学院动物研究所曲静研究员、中国科学院大学生命科学学院陆忠兵教授提供了实验材料并给予宝贵意见。该研究受到国家重点研发计划、国家自然科学基金的资助。
文章链接:
https://academic.oup.com/lifemedi/advance-article/doi/10.1093/lifemedi/lnag001/8431721
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202602/t20260205_1149853.shtml
(供稿:卫涛涛研究组)
附件下载: