
李昂研究组、王晓群研究组合作提出跨物种全脑精准映射计算框架
神经科学与精神医学研究正日益依赖于人类研究与动物模型的互补性优势:人类研究能够提供直接的神经生物学洞察,而小鼠模型则借助先进的遗传工具与神经环路调控技术,实现对因果关系的深入探索--这在人类研究中往往难以实现。然而,在长达数千万年的进化历程中,灵长类大脑相比于啮齿类动物发生了大规模的重组,特别是皮层区域经历了剧烈的扩张与功能特化。如何在人类与小鼠之间建立定量化的比较桥梁,始终是困扰神经科学家的核心难题,这一"翻译鸿沟"也阻碍了大量临床前研究成果成功转化到人类。
2025年12月29日,中国科学院生物物理研究所李昂研究组联合王晓群研究组在《Nature Methods》杂志发表题为 "TransBrain: a computational framework for translating brain-wide phenotypes between humans and mice" 的研究论文。团队开发了名为TransBrain的计算框架,首次实现了人类和小鼠全脑表型的高精度映射。该工作同期被《Nature Methods》以Research Briefing的形式进行了专题报道和评价:"The TransBrain toolbox is original and significant for neuroscience research".
在此之前,跨物种比较方法通常基于先验的"感兴趣"区域来进行同源性比对,这种方式不仅主观性强,且在不同研究中可重复性低,难以实现全脑层面的系统性比较。为了解决这一难题,研究团队系统整合了全脑的空间转录组数据、连接组数据和解剖层级信息,使用人工智能和图模型算法构建了人类和小鼠之间的定量比较框架TransBrain(图)。
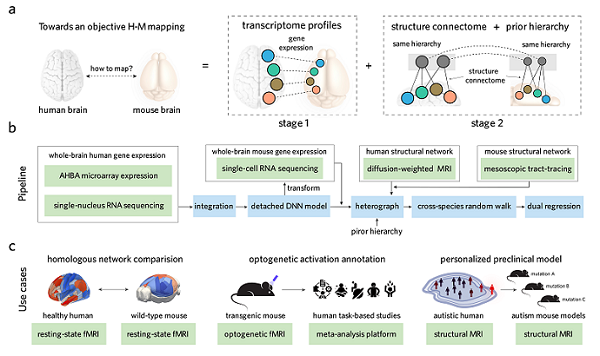
图:TransBrain 的整体流程框架
首先,从人类和小鼠的全脑空间转录组数据出发,团队建立了物种间的分子同源性基础。针对人脑皮层的分子表达远比小鼠复杂以及皮层和皮层下区域转录模式存在广泛差异的特点,研究团队采用了一种分离的深度学习建模策略,从原始的转录组数据中提取区域特异性嵌入(Latent embeddings),相比于原始转录组数据,将皮层同源脑区识别的准确率提升了89.5%。进一步,研究团队揭示了物种间保守的皮层组织原则,表明尽管大脑皮层在物理尺寸上差异巨大,但其核心的分子组织架构在进化中具有高度保守性,从而为跨物种表型转化奠定了分子基础。
接下来,考虑到解剖学连接模式(Anatomical connectivity)和层级结构(Hierarchy)同样限制并塑造着大脑的功能,研究团队构建了跨物种的异构图:将不同物种的脑区作为图模型的节点,物种内部的连边使用小鼠病毒示踪数据和人类纤维束成像的连接组数据提供权重,物种间的连边由转录相似性提供权重,并受到粗尺度的解剖层级约束。通过基于随机游走的图表示学习算法,在物种映射的向量空间中同时引入转录相似性、结构连接约束和解剖层级信息。
最后,通过构建的TransBrain翻译工具,研究团队用三个示例揭示了其潜在的应用场景,这些跨物种的定量比较在此前难以实现:(1)定量刻画了静息状态下大脑功能组织的进化保守性谱系;(2)将小鼠中因果明确的光遗传学脑激活图和人类中内涵丰富的认知行为图谱进行关联注释;(3)利用动物模型解码自闭症患者脑结构异常的分子遗传风险。
总而言之,TransBrain框架的提出将跨物种研究带入到了定量化和系统性建模的新阶段。未来,TransBrain有望在多个方向发挥重要作用:定量预测模式动物中药物诱导的网络变化在人类中的响应,为精神疾病的不同生物亚型匹配最佳的动物模型,将小鼠中因果明确的神经环路研究成果转化为对人类认知功能的理解,从而助力精准精神医学的发展。此外,该框架也将为构建更多物种间的同源性映射方法提供重要参考。TransBrain已完全开源,供全球研究者使用。
中国科学院生物物理研究所李昂研究员和王晓群研究员为该论文的共同通讯作者,生物物理研究所在读博士生黄上铮和张童禹为共同第一作者。该工作受到科技部、国家自然科学基金委、北京市科委、新基石研究员等项目的资助。
文章链接:
https://www.nature.com/articles/s41592-025-02961-3
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202601/t20260123_1146495.shtml
(供稿:李昂研究组)
附件下载: