2012年6月15日,《Genes & Development》杂志上发表了生物物理所刘迎芳实验室和北京生命科学研究所王晓晨实验室的合作研究成果,题为“Structural Study of TTR-52 Reveals the Functional Mechanisms of a Bridging Molecule in Apoptotic Cell Engulfment”。该成果通过结构和功能研究揭示了在秀丽线虫凋亡细胞的清除过程中,桥联分子TTR-52介导吞噬细胞识别凋亡细胞的作用机制。
细胞凋亡后需要被及时清除以维持机体平衡。在线虫中,TTR-52是一个介导凋亡细胞和吞噬细胞的桥联分子,通过识别凋亡细胞上外翻的磷脂酰丝氨酸( PS )来识别凋亡细胞,同时TTR-52也可以结合吞噬细胞上的受体CED-1,进而介导凋亡细胞的吞噬。从序列分析来看,TTR-52类似于transthyretin,一种甲状腺激素结合蛋白。但是过去报道的transthyretin都不具有这种介导凋亡细胞吞噬的功能。为了研究TTR-52的分子机制,我们希望得到TTR-52的晶体结构。在研究初期,重组表达的TTR-52蛋白非常容易聚集成不均一的高聚体,这给我们的结晶工作带来很大的困扰。我们通过Alanine scanning方法筛选了大量突变体,最终发现一个突变体可以形成少量稳定的二聚体,经过晶体筛选,最终解析了这个突变体的晶体结构。并以此突变体为依据,构建了野生型蛋白的结构模型,并进行了功能分析和实验印证。
晶体结构显示TTR-52分子形成一个开放的β桶结构,与含有8个β折叠片的β桶和β三明治结构都不同,TTR-52由7个β折叠片组成的。TTR-52的C端因为缺少一个β折叠片,造成部分疏水核心暴露,这种独特的结构特征按时其具有生物学意义。随后的体内和体外实验都证明TTR-52利用该疏水区域与吞噬受体CED-1结合。此外,TTR-52的第二,第三个loop区域形成一个杯装的负电区,这和transthyretin很不同,却和其他PS结合蛋白,如PKCα, TIM4具有类似之处。经过突变实验,我们发现TTR-52的这两个loop区域可以通过阳离子介导PS的结合,从而识别凋亡细胞;此外,晶体结构中还观察到TTR-52可以形成背靠背的二体,在该二体界面上进行突变可以将二体打开,但是该单体蛋白介导凋亡细胞吞噬的功能大大下降,该结果暗示由二体作为基本单元可能是TTR-52发挥功能的形式。该研究不仅揭示了线虫细胞凋亡中,TTR-52介导吞噬细胞识别凋亡细胞的作用机制,而且对了解其他高等生物中桥连分子介导的凋亡细胞吞噬机制也有一定指导作用。
康彦勇博士(生物物理所),赵东风博士(NIBS)和梁欢欢博士(生物物理所)为本文的共同第一作者。NIBS王晓晨博士与刘迎芳研究员为共同通讯作者。此外,其他一些人员也在此过程中提供了帮助和建议。该项工作得到科技部、基金委、科学院及北京市政府等方面的资助。在此一并致谢。
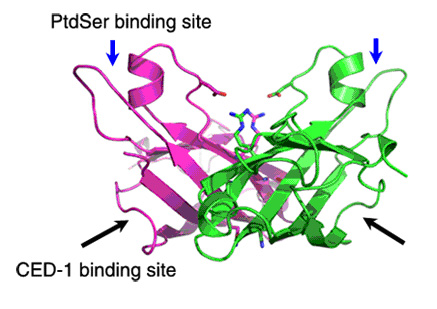
图:TTR-52分子的晶体结构
(供稿:刘迎芳课题组)
 附件下载:
附件下载: