2012年,6岁的美国小女孩Emily在急性淋巴性白血病两次复发濒临死亡时,接受了当时尚未批准的CAR-T治疗。两周之后,Emily体内的癌细胞完全消失,至今Emily已经无癌健康生活了10年。
2018年10月1日,诺贝尔生理医学奖被授予美国科学家詹姆斯·艾利森(James P.Allison)和日本科学家本庶佑(Tasuku Honjo),以表彰他们在"发现抑制负向免疫调控的肿瘤疗法"中所做出的贡献。
2021年6月,国家药品监督管理局批准复星凯特生物技术有限公司申报的阿基仑赛注射液 (商品名:奕凯达)上市。该药品为中国首个批准上市的细胞治疗类产品,用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,然而高达上百万的治疗费用让众多患者望而却步。
……
现如今,免疫治疗逐渐进入人们的视野,成为一种全新的癌症治疗方法,为更多的癌症患者带来了希望和福音。让我们来简单地认识一下免疫治疗吧。
癌症和免疫
细胞异常增生且会局部浸入周遭正常组织甚至经由体内循环系统或淋巴系统转移到身体其他部位,人们常称为恶性肿瘤或癌症。只有细胞增生而不会侵犯身体其他部位,则是良性肿瘤[1]。免疫是指机体识别"自己"和"非己",对"非己"产生免疫应答并清除的过程。免疫系统能够识别肿瘤细胞所表达的特异性抗原表位,从而清除体内自发产生的肿瘤细胞,即免疫监视。然而肿瘤细胞能够通过多种方式逃避免疫系统的清除,形成免疫逃逸[2]。肿瘤和免疫系统就像是一场战争的敌对双方,肿瘤战胜了免疫系统,肿瘤就逐渐生长起来并最终导致个体死亡;免疫系统战胜肿瘤,肿瘤细胞就被清除。但是,肿瘤在与机体免疫系统的长期斗争中,进化出了多种多样的抵抗手段,变得异常的"狡猾",结果往往就是机体免疫系统败下阵来,肿瘤细胞在身体中安营扎寨、肆意生长。为什么强大的免疫系统不敌肿瘤而任由肿瘤肆虐,这是一个十分复杂的问题。但是我们仍然相信免疫系统的强大保护能力,我们仍然可以依靠自身的免疫系统来打赢这场与肿瘤的战斗。于是,免疫治疗应运而生。
免疫治疗
传统的癌症治疗方法,包括化疗、放疗等,主要是针对肿瘤细胞本身,对肿瘤细胞进行直接的杀伤以达到抑制或清除肿瘤的目的。但在治疗过程中,会使患者产生严重的副作用,对患者的身体和生活造成极大的影响。不同于传统的治疗方法,免疫治疗着眼于机体自身的免疫系统,依靠自身强大的免疫能力来清除肿瘤细胞,消灭癌症。接下来简要地介绍几种当下研究比较深入的免疫治疗方法。
1. 免疫检查点阻断治疗
免疫系统就像是一台极为精密和复杂的机器,各种精巧复杂的调控网络维持着机体免疫系统的正常运转。机体需要强大的免疫能力去清除外来的"有害分子",但同时也需要精密的调控机制以避免免疫系统对自身组织的损伤。一旦失控,免疫系统就可能对自身组织进行无差别的攻击,这样就会导致多种自身免疫病的出现。这些免疫系统的负向调控机制,本身是为了维持免疫平衡,却被肿瘤"挟持"利用,成为肿瘤对抗免疫系统的"帮凶"。免疫检查点就是免疫系统的调节分子,PD-1/PDL1、CTLA-4等免疫检查点分子逐渐被发现并得到深入研究。CD8+T细胞在机体抗肿瘤免疫过程中具有举足轻重的作用,免疫检查点分子PD-1和PDL1相互作用,能够向CD8+T细胞传递抑制性信号,抑制CD8+T的功能,阻碍其对肿瘤细胞的有效杀伤[3]。为了解除对CD8+T细胞的抑制,重新释放CD8+T细胞的活性,恢复机体抗肿瘤的能力,研究者使用抗体进行免疫检查点阻断,这些抗体能够特异性结合PD-1分子或者PD-L1分子,阻碍其相互作用[6](图1)。经过长期的临床前和临床研究,最终多种免疫检查点阻断抗体已经获批上市。比如我们常听到的O药(纳武利尤单抗)和K药(帕博利珠单抗),就是PD-1单抗,获批治疗多种癌症,至今已经为无数的癌症患者带来了福利。尽管如此,免疫检查点阻断治疗仍存在应答率低[4]、获得性抵抗[5]、肿瘤复发等问题。

图1.抗体结合PD-1或者PD-L1解除肿瘤细胞对T细胞的抑制
2. CAR-T治疗
如果患者体内的免疫系统无法有效地清除杀伤肿瘤,除了激活患者体内固有的免疫细胞,还有另一种解决思路,即外源地输入免疫细胞,为免疫大军"添兵加将"。首先从患者体内获得T细胞,为了使T细胞能够特异性的识别并高效地杀伤肿瘤,需要对这些T细胞在体外进行基因改造,使其表达肿瘤抗原受体,改造后的T细胞"披坚执锐",然后回输到患者体内,对肿瘤进行杀伤清除[6](图2)。这就是CAR-T(chimeric antigen receptor-T)治疗,全称嵌合抗原受体T细胞治疗。
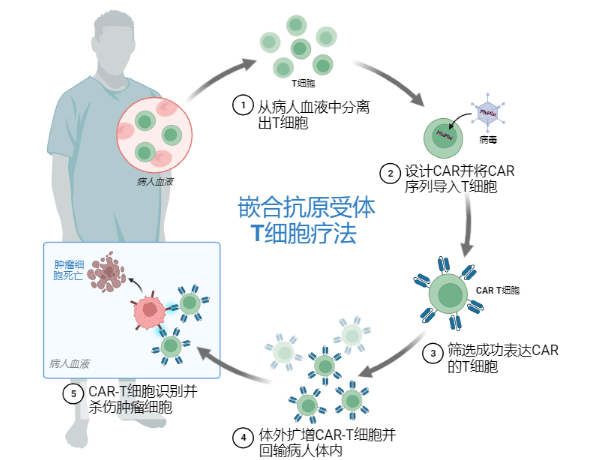
图2. CAR-T细胞治疗的流程
CAR-T逐渐发展,结构逐渐优化。CAR主要包括抗原结合结构域和信号激活结构域,这两部分结构域对于CAR-T的功能都是必不可少的。第一代CAR的胞内段只包括第一信号激活结构域,并不能最佳激活CAR-T细胞。第二代CAR的胞内段包括第一信号和第二信号(共刺激)结构域,能为CAR-T细胞提供更强的激活信号[7]。美国FDA批准的第一个CAR-T细胞疗法-Kymriah,就是第二代CAR-T。第三代CAR的胞内段再添加了一个共刺激结构域,以期获得更强的对CAR-T的激活信号[7]。
CAR-T治疗在白血病和淋巴瘤中取得了令人惊喜的治疗效果,许多患者的肿瘤细胞得到完全清除并长期没有肿瘤复发。尽管如此,CAR-T治疗也存在严重的副作用,最常见并最严重的副作用是细胞因子释放综合征(cytokine release syndrome, CRS)。回输的CAR-T细胞产生大量的细胞因子,进而导致严重的毒副作用,包括高烧和血压急剧下降,严重的情况下会导致死亡。尽管CRS可能对患者造成严重的损伤甚至威胁生命,但患者出现CRS往往代表回输的CAR-T细胞被激活起来,正在对肿瘤细胞进行杀伤。幸运的是,一类抗炎症药物--托珠单抗(tocilizumab)能够有效地缓解CRS[6]。另外一个更为实际的问题就是CAR-T治疗的费用,由于CAR-T治疗需要从患者自身获得T细胞,对于每位患者来说都是"私人订制"的,再加上体外复杂的改造培养过程,使得CAR-T治疗的费用十分的高昂。中国首位接受商业化CAR-T治疗并获得完全缓解的患者曝光了CAR-T治疗的费用,约120万元/针,如此高昂的费用对于绝大部分的患者是难以承担的。
3. 免疫调节剂治疗
免疫调节剂通常是指一类能够增强免疫能力对抗肿瘤的分子,其中细胞因子作为免疫系统中的重要组成之一,对于多种免疫细胞的生成发育和免疫功能都有着十分重要的作用。研究较多的细胞因子主要包括干扰素(interferon)和白介素(interleukin),这些细胞因子家族中很多成员均能有效增强免疫能力,提高机体杀伤肿瘤的能力。以白介素-2(IL-2)为例,IL-2能够促进T细胞的分化和存活,增强T细胞和NK细胞的杀伤能力,因而能够增强机体抗肿瘤的能力。美国FDA在1992年和1998年批准高剂量的IL-2(阿地白介素,aldesleukin)分别用于治疗肾细胞癌和黑色素瘤[8]。但是阿地白介素在使用时会导致明显的毒副作用,包括血管渗透综合征症和细胞因子风暴[8],因而并没有得到广泛的使用。尽管细胞因子具有很大的潜在临床转化价值,但是严重的副作用极大地阻碍细胞因子的临床应用,之后再没有细胞因子疗法得到FDA的批准。针对细胞因子应用中的关键问题,傅阳心和彭华课题组近些年来深耕细胞因子领域,创造性地提出了多种工程化改造策略。
第一种改造策略是细胞因子前药(pro-cytokine)。前药(pro-drug)是指具有很少或没有药理活性的分子,在体内通过酶促或化学反应转化为活性药物。借用前药的概念,傅阳心和彭华课题组提出了细胞因子前药的改造策略。为了避免细胞因子在外周循环时激活外周免疫系统而出现的严重副作用,我们使用细胞因子受体作为"帽子"遮盖住细胞因子,形成细胞因子前药。当细胞因子前药到达肿瘤组织,肿瘤组织特异性的蛋白酶化身一把"剪刀",将"帽子"剪开释放,细胞因子重新获得活性,激活瘤内的免疫细胞进而发挥抗肿瘤作用。这种改造策略能够使细胞因子的活性特异性地在肿瘤组织局部展现出来,特异性地激活抗肿瘤免疫反应,最大程度地避免对外周正常组织的影响。傅阳心和彭华课题组前期在IL-2[9]、IL-12[10]、IL-15[11]、IFN-α[12]等细胞因子上已经成功完成了前药改造,这些改造方式很好地解决了细胞因子应用时的副作用,在临床前肿瘤模型取得了不错的效果,具有很大的临床转化价值。
第二种改造策略是肿瘤靶向细胞因子。为了使细胞因子能够更多地驻留在肿瘤组织,傅阳心和彭华课题组将肿瘤靶向抗体和细胞因子构建成融合蛋白,借助抗体特异结合肿瘤里抗原的作用,使细胞因子更多地激活肿瘤内的淋巴细胞。作为肿瘤组织的基本组成成分,肿瘤细胞、基质细胞和免疫细胞上的分子均可以作为靶向抗体的靶标,为了保证肿瘤靶向效率和减少副作用,肿瘤组织特异性表达或高水平表达的分子才有希望作为理想的靶向分子。我们采用多种靶向抗体和细胞因子构建成融合蛋白[13-16] ,这些融合蛋白在小鼠肿瘤模型中均取得了较好的肿瘤靶向效果和更强的抑制肿瘤的作用。特别是最近在《Journal of Experimental Medicine》杂志发表的一项工作[17],我们将IL-15和anti-PD-1抗体分子构建成融合蛋白,还巧妙地利用抗体的Fc结构域以空间位阻的形式阻碍IL-15与受体的结合,也形成一种细胞因子前药的形式。不同于传统的需要酶切释放活性的细胞因子前药,当融合蛋白与肿瘤内PD-1+CD8+T细胞结合,遮盖的IL-15的活性又极大的释放出来,以顺式作用的方式激活这些PD-1+CD8+T细胞(图3)。我们仅仅使用抗体和IL-15的融合形式,就实现了肿瘤靶向和细胞因子前药的效果,并且更重要的是,IL-15的活性被更特异性地限制在肿瘤内高表达PD-1分子的CD8+T细胞,使得IL-15的作用更精准更高效,不仅提升了使用的安全性,还展现出显著增强的抗肿瘤效果。
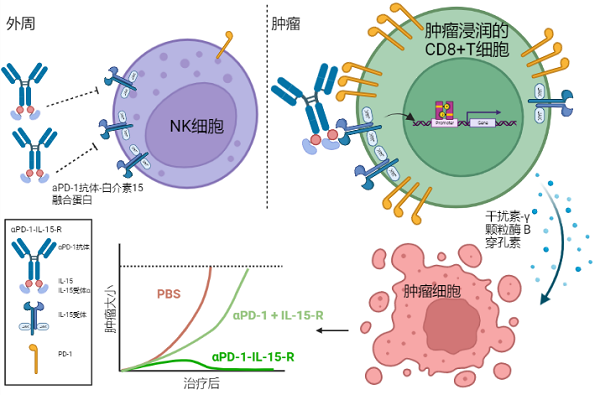
图3. aPD-1-IL-15-R抗肿瘤作用示意图
由于aPD-1抗体的空间位阻效应,aPD-1-IL-15-R基本不激活外周的NK细胞。肿瘤浸润CD8+T细胞高表达PD-1分子,当aPD-1-IL-15-R中aPD-1抗体结合细胞表面的PD-1分子,IL-15能够与受体结合,活性恢复,激活CD8+T细胞进而杀伤肿瘤细胞。aPD-1-IL-15-R比简单的aPD-1抗体和IL-15的联合治疗具有更强的抑制肿瘤效果。
总结
简单的说,免疫治疗即引导和利用个体自身的肿瘤特异性免疫能力来对抗肿瘤。除了上面介绍的免疫治疗方法,还包括抗体药物、肿瘤疫苗等。尽管免疫治疗大大改变了肿瘤治疗的局面,但是免疫治疗仍存在很多局限,比如应答率低、适应症少、肿瘤复发、费用高昂等等。面对这些难题,首先对肿瘤和免疫系统进行更深入更全面的研究,将有助于开发出更精准更有效的治疗方法。另外还需要政府、药企等社会各方面的共同努力,才能使这些新的药物或治疗方法真正造福更多的癌症患者,让更多的患者早日摆脱癌症的厄运。这是一场没有硝烟但异常惨烈的战斗,每一分每一秒都有人在与癌症的战斗中不幸离去,希望在未来能够寻找到致胜的法宝,真正地杀死肿瘤战胜癌症。路漫漫其修远兮,吾将上下而求索。最后值得大家重视的还是保持健康生活、远离致癌因素,毕竟健康的身体才是革命的本钱。
参考文献:
1. https://www.cancer.gov/about-cancer/understanding/what-is-cancer
2. Kim R, Emi M, Tanabe K. Cancer immunoediting: from immune surveillance to immune escape. Immunology, 2007, 121(1): 1-14
3. Pardoll D M. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer, 2012, 12(4): 252-264
4. Park Y J, Kuen D S, Chung Y. Future prospects of immune checkpoint blockade in cancer: from response prediction to overcoming resistance. Exp Mol Med, 2018, 50(8): 1-13
5. Schoenfeld A J, Hellmann M D. Acquired resistance to immune checkpoint inhibitors. Cancer Cell, 2020, 37(4): 443-455
6. https://www.cancer.gov/about-cancer/treatment/types/immunotherapy
7. Jackson H J, Rafiq S, Brentjens R J. Driving CAR T-cells forward. Nat Rev Clin Oncol, 2016, 13(6): 370-383
8. Overwijk W W, Tagliaferri M A, Zalevsky J. Engineering IL-2 to give new life to T cell immunotherapy. Annu Rev Med, 2021, 72: 281-311
9. Hsu E J, Cao X, Moon B, et al. A cytokine receptor-masked IL2 prodrug selectively activates tumor-infiltrating lymphocytes for potent antitumor therapy. Nat Commun, 2021, 12(1): 2768
10. Xue D, Moon B, Liao J, et al. A tumor-specific pro-IL-12 activates preexisting cytotoxic T cells to control established tumors. Sci Immunol, 2022, 7(67): eabi6899
11. Guo J, Liang Y, Xue D, et al. Tumor-conditional IL-15 pro-cytokine reactivates anti-tumor immunity with limited toxicity. Cell Res, 2021, 31(11): 1190-1198
12. Cao X, Liang Y, Hu Z, et al. Next generation of tumor-activating type I IFN enhances anti-tumor immune responses to overcome therapy resistance. Nat Commun, 2021, 12(1): 5866
13. Sun Z, Ren Z, Yang K, et al. A next-generation tumor-targeting IL-2 preferentially promotes tumor-infiltrating CD8+ T-cell response and effective tumor control. Nat Commun, 2019, 10(1): 3874
14. Ren Z, Zhang A, Sun Z, et al. Selective delivery of low-affinity IL-2 to PD-1+ T cells rejuvenates antitumor immunity with reduced toxicity. J Clin Invest, 2022, 132(3): e153604
15. Deng S, Sun Z, Qiao J, et al. Targeting tumors with IL-21 reshapes the tumor microenvironment by proliferating PD-1intTim-3-CD8+ T cells. JCI insight, 2020, 5(7): e132000
16. Liang Y, Tang H, Guo J, et al. Targeting IFNα to tumor by anti-PD-L1 creates feedforward antitumor responses to overcome checkpoint blockade resistance. Nat Commun, 2018, 9(1): 4586
17. Shen J, Zou Z, Guo J, Cai Y, et al. An engineered concealed IL-15-R elicits tumor-specific CD8+ T cell responses through PD-1-cis delivery. J Exp Med, 2022, 219(12): e20220745
作者简介:

邹壮志
中国科学院生物物理研究所免疫治疗组博士研究生,研究方向为白介素-12的应用和机制研究。
科学寄语
仰望星空,脚踏实地。
 附件下载:
附件下载: