自1937年法国科学家Laufberger首次从马的脾脏中提取分离得到铁蛋白(Ferritin)以来,铁蛋白的相关研究至今已有近90年的历史[1]。铁蛋白是一种广泛存在于生物体内的铁储存蛋白。其生物学功能主要是参与铁代谢,在维持机体铁平衡和细胞抗氧化中起着重要作用。在真核细胞内,铁蛋白通常是由24个独立亚基组成的多聚体蛋白。其中,亚基类型包括重链铁蛋白(H亚基)和/或轻链铁蛋白(L亚基)。这些亚基能够自组装形成高度有序的铁蛋白纳米笼。其外径为12 nm,内径为8 nm(图1)。凭借独特的笼状结构,每个铁蛋白能在内腔储存多达4500个铁原子。而不含铁核的铁蛋白则称为去铁铁蛋白(Apoferritin),目前作为药物载体被广泛研究和应用。
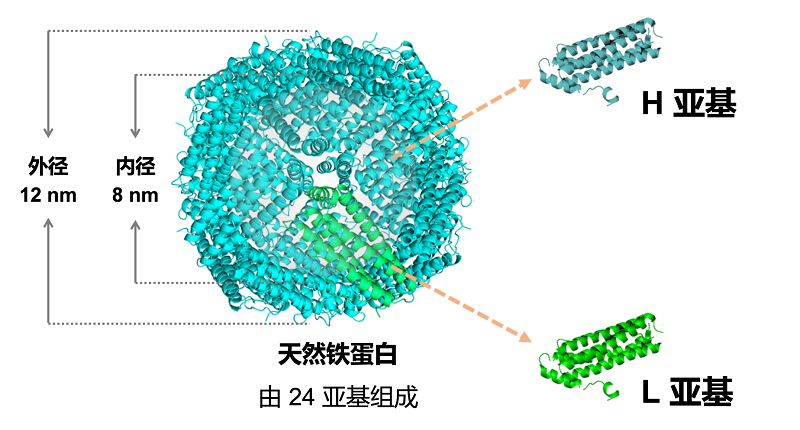
图1 铁蛋白结构示意图
传统纳米药物载体存在生物相容性差、输送效率不理想、毒性较强等问题。而铁蛋白作为人体内源性的天然蛋白质,其独特的蛋白笼结构以及自组装特性为药物载体提供了新思路。阎锡蕴院士团队在十几年的铁蛋白系列研究工作中发现,人重链铁蛋白(human heavy chain ferritin,简称HFn)是肿瘤标志分子--转铁蛋白受体1(transferrin receptor 1,TfR1/CD71)的新配体。这个发现赋予了铁蛋白作为肿瘤靶向药物载体的巨大潜能。同时他们还发现,铁蛋白能够穿越血脑屏障,具备靶向治疗脑瘤的新特性[2-3]。近期,该团队发现在铁蛋白笼上存在温度可控的小分子药物通道,这为解决铁蛋白药物装载的关键技术难题提供了新策略[4]。随后,该团队的相关工作证实了铁蛋白载体能有效提高多种药物的体内治疗疗效,同时显著降低毒副作用[5-6]。
随着铁蛋白研究的深入,"铁蛋白药物载体(ferritin drug carrier,FDC)"这一新概念开始逐渐被人们所熟知,在基础研究和临床转化中也掀起了一波铁蛋白的研究浪潮。目前,铁蛋白药物载体成功实现了对多种药物分子、成像剂以及金属纳米粒的有效装载,也广泛应用于体内递送、生物成像、疾病诊疗等多个生物医学领域[6-8]。在此,我们汇总了铁蛋白药物载体的优势,具体如下(图2):
(1)笼状的空间结构:铁蛋白具备独特的笼状结构,其中空内腔是封装药物的理想空间。相关研究数据表明,铁蛋白载体具有较高药物装载率,而内腔装载的方式也能更好地确保药物在体内递送过程中的稳定性和安全性;
(2)简单高效的药物装载方式:铁蛋白纳米笼具备可逆的自组装能力。因此,铁蛋白通过蛋白笼的解组装/再组装过程就能有效地完成药物装载。以pH介导的药物装载法为例,铁蛋白在强酸/强碱条件下, 其24聚体蛋白笼会发生解聚。而当溶液pH值恢复中性时, 解聚的亚基又可重组装为多聚体蛋白笼,同时完成药物的内部包载。此外,研究人员还利用铁蛋白上温度敏感的天然药物通道开发了热载法。它通过简单的温度调节就能将亲水性的小分子药物高效稳定地装载至内腔[4];
(3)固有的肿瘤靶向性:铁蛋白具有天然的肿瘤靶向性。这赋予了铁蛋白药物载体在肿瘤靶向治疗中的独特优势。研究表明,在荷瘤小鼠体内,铁蛋白载体会高度富集在肿瘤组织。相较于游离药物,铁蛋白装载的药物在肿瘤细胞中的浓度可提高将近10倍[5];
(4)具有功能修饰性:铁蛋白可通过大肠杆菌原核表达,易于借助基因工程改造以实现功能化设计[9]。此外,分布在铁蛋白纳米笼外表面的赖氨酸和半胱氨酸残基可与N-羟基琥珀酰亚胺(NHS) 酯或马来酰亚胺基团进行交联,进而化学偶联相应的功能组件。因此,根据应用需求,铁蛋白外表面可通过基因和化学手段进行多功能修饰,进而获得针对不同疾病的特异靶向性以及更为丰富的诊疗功能;
(5)优异的体内安全性:作为内源性蛋白,铁蛋白具有低免疫原性、高生物相容性和易于降解等优良性质。这确保了铁蛋白药物载体在体内递送过程中的安全性,也奠定了其在生物医学领域的转化应用基础。
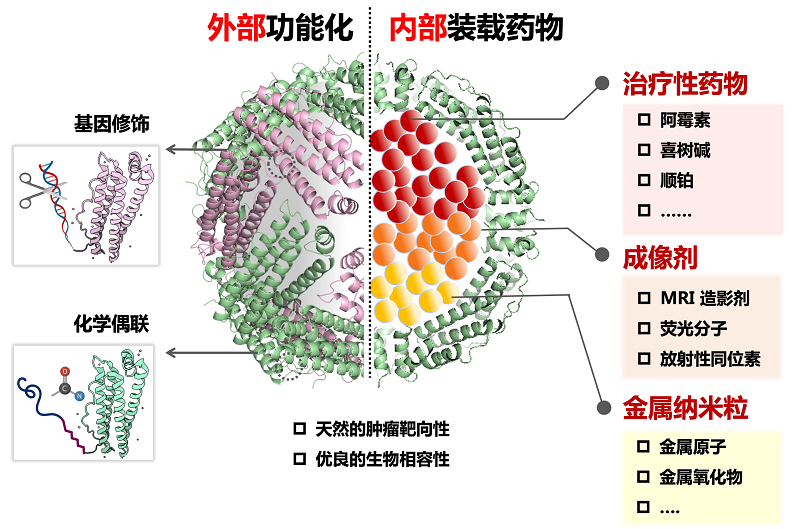
图2 铁蛋白作为药物载体的优势
经过十余年的努力,铁蛋白在装载化疗药物、成像剂及金属纳米粒等方面已经取得引人瞩目的进展。近年来,核酸药物逐渐成为生物医药领域关注的新焦点,而体内递送是核酸药物发展目前亟需攻克的瓶颈问题。因此,研究人员也开始探究铁蛋白载体在核酸装载及体内递送方面的潜能。
相较于传统药物,核酸药物具有治疗靶点明确、制备简单、持久高效等特点,在肿瘤及遗传病治疗中表现出显著的优越性。然而,目前核酸药物的转化应用却严重受限于其体内递送问题(图3),包括(1)核酸结构的不稳定性,易被血液和组织中的核酸酶降解;(2)外源性核酸分子具有免疫原性,在体内易引发免疫清除;(3)核酸的亲水性和负电性使其难以透过细胞膜被细胞摄取,这导致核酸药物的组织渗透性差和细胞利用率低;(4)核酸药物进入细胞后难以有效到达作用位点[10]。毋庸置疑,核酸药物的发展亟需安全高效的核酸递送系统。

图3 核酸体内递送存在的问题[11]
虽然相关研究已开发出了一系列的核酸载体,包括阳离子脂质体、阳离子聚合物、病毒载体和一些新型纳米递送系统,但这些载体潜在的安全性问题却也十分令人担忧(图4)。例如,具有高阳离子的脂质体/聚合物容易与细胞膜发生非特异性结合,进而导致体内细胞的急性损伤;病毒载体所含有的病毒蛋白具有强致癌性和生物遗传毒性风险;新型纳米载体所用的人工合成材料具有明显的免疫原性及体内代谢问题等[12-13]。从目前的研发情况来看,具有高生物安全性和低免疫原性的铁蛋白是极具应用潜力的核酸载体材料。
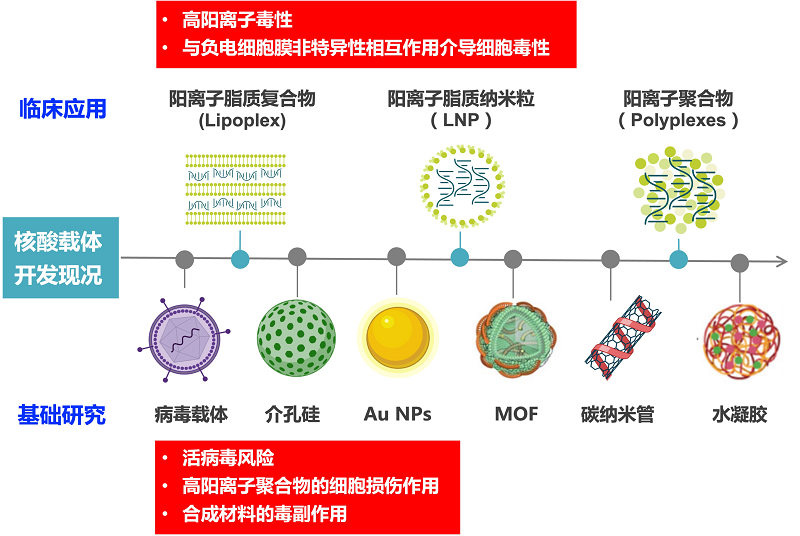
图4 现有核酸载体的开发现况及其存在的问题(引用BioRender素材绘制)
然而,铁蛋白作为核酸载体的发展也受限于其蛋白质结构的天然负电性,这使其难以有效装载同样带负电的核酸药物。通常情况下,铁蛋白内表面富含谷氨酸和天冬氨酸等酸性残基。这些酸性氨基酸的等电点为5.0~6.0。因此,铁蛋白内腔往往呈现很高的负电荷密度。目前,已有相关研究尝试通过正电改造以提高铁蛋白的核酸亲和力[14-15],但也随之带来一些问题。例如,在铁蛋白外表面进行正电修饰或融合正电肽的策略存在一些问题,包括:(1) 铁蛋白外表面性质的改变易于引发免疫原性;(2) 依赖静电作用吸附在蛋白外表面的核酸在循环系统中易被强大的血流剪切力所剥离。这会导致核酸药物的非靶标提前释放,从而引发正常组织毒性;(3)位于铁蛋白载体外表面的核酸易与血液环境中的核酸酶相互作用,使得核酸药物降解失效。至于铁蛋白内部正电改造的现有策略,虽然内部装载可以提高核酸的稳定性,但是铁蛋白内表面融合的正电肽会占据内腔空间进而降低核酸装载量(图5)。
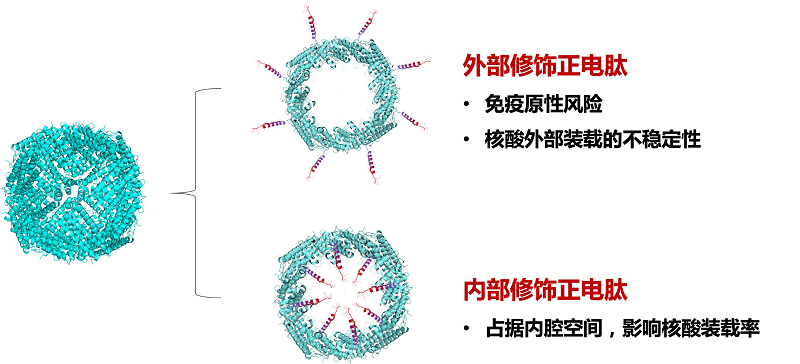
图5 现有铁蛋白-核酸载体的开发策略及其存在的问题
为了更好地解决铁蛋白在装载核酸药物中存在的问题,近日阎锡蕴院士团队通过对铁蛋白内表面进行点突变的方式,成功构建了具备正电内腔的铁蛋白载体HFn(+)[16]。该改造策略在不影响内腔装载空间的基础上,实现了铁蛋白内表面由"负"到"正"的转变。具体来说,研究人员基于对铁蛋白空间结构的分析,针对性地将位于铁蛋白内表面的负电氨基酸--谷氨酸(Glu, D)和/或天冬氨酸(Asp, E)突变为正电氨基酸--赖氨酸(Lys, K)和/或精氨酸(Arg, R),进而构建了一系列具有不同突变位点和数目的内腔正电铁蛋白。随后,他们对这些突变体的结构性质、自组装能力、核酸装载性能和稳定性进行了系统性评估和综合考量,从中优选了装载效率和稳定性能最佳的HFn(+) 突变体作为铁蛋白-核酸载体。蛋白质表面电势的理论分析及实验表征结果均显示,HFn(+) 铁蛋白突变体的内表面电荷性明显逆转为正电主导。更为关键的是,HFn(+) 的外表面性质相比于野生型铁蛋白却基本保持不变(图6)。这说明该改造策略可以精准地正电化铁蛋白内表面,而不干扰铁蛋白外部性质。因此,HFn(+) 突变体在提高核酸装载率的同时有效避免在体内引发免疫原性的风险。
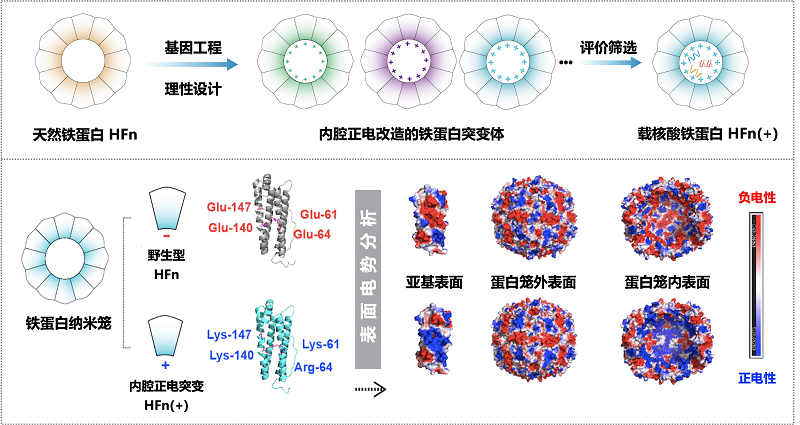
图6 内腔正电改造铁蛋白的设计及表征
Toll样受体(Toll-like receptors,TLRs)是肿瘤免疫激活的有效靶点之一。近年来,大量研究表明TLR相关激活配体是极具应用潜力的抗肿瘤免疫佐剂。然而,具有核酸结构特性的TLR激活配体却囿于体内递送问题,难以在肿瘤免疫治疗中大显身手。因此,在载核酸铁蛋白的应用研究中,研究人员选取了TLR核酸配体作为代表性核酸药物,以pH介导的解组装/再组装方式将其装载进铁蛋白内腔(图7)。结果显示,HFn(+) 载体能高效装载多种类型 TLR(TLR3、TLR7/8和 TLR9)的核酸配体,对不同结构的核酸具有装载普适性。更重要的是,HFn(+) 载体显著改善了TLR核酸配体的体内外递送效率,表现出高效的细胞摄取、特异的胞内定位和增强的免疫激活作用(图8)。
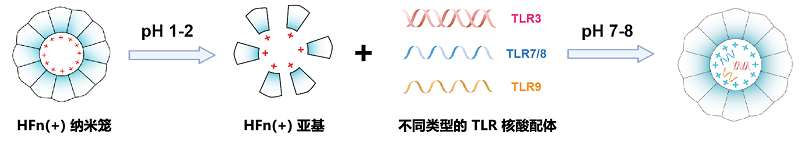
图7 基于pH 法在铁蛋白笼内部装载TLR核酸配体的制备示意图
利用铁蛋白独特的笼状结构和可基因/化学修饰的特性,HFn(+)载体在装载TLR核酸配体的基础上,可进一步构建为光动力(photodynamic therapy,PDT)-免疫联合治疗平台。研究人员首先利用 pH装载法将TLR9 核酸配体CpG ODNs包载至HFn(+) 蛋白笼的内腔。随后,在HFn(+) 外表面化学修饰PDT光敏剂二氢卟吩6(Ce6)。其具体策略是,利用化学手段对Ce6的羧基进行活化,进而与铁蛋白表面氨基共价偶联。构建所得的Ce6-CpG@HFn(+)一方面能通过PDT介导肿瘤细胞的免疫原性死亡(immunogenic death,ICD),进而促进大量肿瘤相关抗原的产生及释放。另一方面CpG ODNs作为免疫佐剂可有效增强树突状细胞(dendritic cell,DC)的抗原呈递能力。二者相辅相成,协同引发体内 T 细胞活化并激活系统性抗肿瘤免疫响应。在荷瘤小鼠模型中,Ce6-CpG@HFn(+) 显著抑制了双侧瘤生长及远端转移的发生(图8)。更重要的是,铁蛋白-核酸载体在体内外都表现出良好的生物安全性。
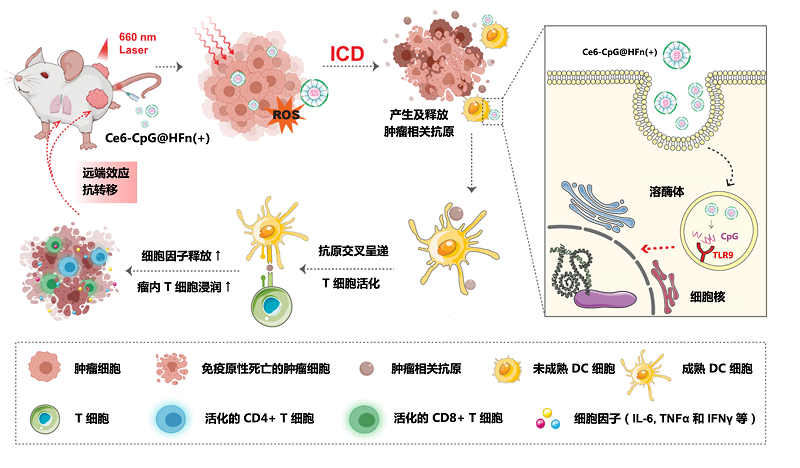
图8 铁蛋白-核酸递送系统及其增效抗肿瘤免疫的示意图
综上,该研究构建的内腔正电铁蛋白HFn(+) 为核酸药物提供了一个安全高效的新型体内递送系统。作为核酸载体中的新兴潜力股,铁蛋白-核酸载体的发展之路仍存在着很多机遇与挑战。
于此,浅述几点关于铁蛋白-核酸递送系统研究的未来展望:(1)铁蛋白具备天然的脑靶向性和穿越血脑屏障的能力,这赋予了铁蛋白在恶性脑瘤和中枢神经系统相关疾病治疗中得天独厚的优势[3]。因此,利用铁蛋白载体递送脑部疾病相关核酸药物将是一个极具前景的研究方向;(2)胞内靶标精准递送。通常情况下,铁蛋白装载的药物会通过受体介导的细胞内吞过程进入溶酶体。由于TLR核酸配体的胞内作用位点为溶酶体,因此借助铁蛋白载体可直接定位递送至胞内靶标。但是绝大多数现有核酸药物的胞内起效位点为胞质或细胞核,因此很有必要对铁蛋白载体进行进一步功能化设计,以实现溶酶体逃逸或直接胞质定向的细胞内吞。这样才能使铁蛋白载体普适和惠及更多核酸药物;(3)铁蛋白的内腔空间较为有限。目前铁蛋白载体仅可满足对小核酸药物的装载,对于mRNA 之类的大分子质量核酸药物仍存在装载瓶颈。因此,扩大改造现有铁蛋白载体的内腔空间、评估具有更大内腔的其他类型铁蛋白的核酸装载潜能,以及高效安全的外部装载都是领域未来值得探究的方向;(4)除了肿瘤靶向和穿越血脑屏障等特性之外,铁蛋白作为生物内源性蛋白可能还存在其他生物学功能有待发掘,下一个新特性的发现或许就能谱写出铁蛋白药物载体的新篇章。
参考文献:
1. Laufberger V. Sur la cristallisation de la ferritine. Soc Chim Biol, 1937, 19: 1575-1582
2. Fan K, Cao C, Pan Y, et al. Magnetoferritin nanoparticles for targeting and visualizing tumour tissues. Nat Nanotechnol, 2012, 7(7): 459-464
3. Fan K, Jia X, Zhou M, et al. Ferritin nanocarrier traverses the blood brain barrier and kills glioma. ACS Nano, 2018, 12(5): 4105-4115
4. Jiang B, Chen X H, Sun G M, et al. A natural drug entry channel in the ferritin nanocage. Nano Today, 2020, 35: 100948
5. Liang M, Fan K, Zhou M, et al. H-ferritin-nanocaged doxorubicin nanoparticles specifically target and kill tumors with a single-dose injection. Proc Natl Acad Sci USA, 2014, 111(41): 14900-14905
6. He J, Fan K, Yan X. Ferritin drug carrier (FDC) for tumor targeting therapy. J Control Release, 2019, 311-312(288-300.
7. Jiang B, Fang L, Wu K M, et al. Ferritins as natural and artificial nanozymes for theranostics. Theranostics, 2020, 10(2): 687-706
8. Zhang B, Tang G, He J, et al. Ferritin nanocage: a promising and designable multi-module platform for constructing dynamic nanoassembly-based drug nanocarrier. Adv Drug Deliv Rev, 2021, 176: 113892
9. Jin Y, He J, Fan K, et al. Ferritin variants: inspirations for rationally designing protein nanocarriers. Nanoscale, 2019, 11(26): 12449-12459
10. Zhang Z, Conniot J, Amorim J, et al. Nucleic acid-based therapy for brain cancer: challenges and strategies. J Control Release, 2022, 350: 80-92
11. Gupta A, Andresen J L, Manan R S, et al. Nucleic acid delivery for therapeutic applications. Adv Drug Deliv Rev, 2021, 178: 113834
12. Xia W T, Tao Z X, Zhu B, et al. Targeted delivery of drugs and genes using polymer nanocarriers for cancer therapy. Int J Mol Sci, 2021, 22(17): 9118
13. David R M, Doherty A T. Viral vectors: the road to reducing genotoxicity. Toxicol Sci, 2017, 155(2): 315-325
14. Lee E J, Lee S J, Kang Y S, et al. Engineered proteinticles for targeted delivery of siRNA to cancer cells. Adv Funct Mater, 2015, 25(8): 1279-1286
15. Huang H Q, Yuan S R, Ma Z, et al. Genetic recombination of poly(l-lysine) functionalized apoferritin nanocages that resemble viral capsid nanometer-sized platforms for gene therapy. Biomater Sci, 2020, 8(6): 1759-1770
作者简介:

张宝丽
中国科学院生物物理研究所阎锡蕴组在读博士生,研究方向为铁蛋白药物载体及其在生物医学中的应用。
科学寄语
希望铁蛋白载体研究更深更广,在生物医学领域中进一步发光发热。
 附件下载:
附件下载: