纳米粒(nanoparticles, NPs)作为探针或药物递送载体已经受到广泛关注。细胞膜仿生修饰纳米粒(cell membrane biomimetic modified nanoparticles, CMBMNPs)通过将天然或仿生细胞膜材料修饰于合成NPs表面,得到的CMBMNPs具有高度可控的生物学功能。CMBMNPs不会破坏NPs原有的物理化学性质,同时还利用细胞膜表面蛋白质和多糖的功能使NPs避免被免疫系统攻击【1】。与未进行细胞膜仿生修饰的NPs相比,修饰后的NPs具有更长的体内循环时间。同时,细胞膜修饰策略可以提高NPs的肿瘤靶向能力,而不同的细胞膜来源可赋予NPs多样的肿瘤治疗作用。这使CMBMNPs在肿瘤治疗领域表现出巨大潜力。我们来看看CMBMNPs在肿瘤靶向化疗、光热诊疗、免疫治疗方面的最新应用进展吧。
肿瘤靶向化疗
在肿瘤中,癌细胞表面抗原具有同源或异源黏附特性【2】。这些特性归因于癌细胞表面的质膜蛋白,包括N-钙黏蛋白、半乳糖凝集素-3和上皮细胞黏附分子【3】,NPs表面包被癌细胞膜(cancer cell membrane, CCM)可以竞争同型癌细胞表面抗原,获得免疫逃逸和同源靶向能力,可用于高度特异性的癌症靶向和有效的癌症治疗【4】。Zhu等【5】制备了一种磁性氧化铁纳米粒(Fe3O4MNPs)平台,用来自多种癌细胞系的CMBMNPs研究其同源靶向能力。实验结果表明,癌细胞膜仿生修饰的Fe3o4 MNPs可以在体外对源癌细胞系实现高度特异性的自我识别,并且对同源肿瘤具有出色的靶向能力。甚至当存在异型肿瘤竞争时,该NPs仍然选择性地靶向同源肿瘤(图1)。

图1 癌细胞膜包被磁性纳米粒的制备和癌细胞自我识别、肿瘤自我靶向示意图
肿瘤光热诊疗
光动力治疗(photodynamic therapy, PDT)是一种依赖于光疗药物的非侵入性方法,结合光照射选择性地杀死癌细胞,对无光照射的正常组织的毒性小。光热疗法使用光吸收剂在高近红外(near-infrared, NIR)激光照射下产生热量,导致癌细胞热消融。一系列细胞膜修饰在光治疗纳米粒的表面上赋予了NPs新的生物学功能。
最近报道,一种利用激活成纤维细胞(activated fibroblast, AF)的细胞膜包被的半导体聚合物纳米粒(semiconducting polymer nanoparticle, SPN)可用于增强肿瘤光疗法【6】。这种称为AF-SPN的纳米复合物包括含有NIR吸收的半导体聚合物SP和AF细胞膜(图2)。SP作为治疗诊断剂,不仅可以产生用于成像的NIR荧光,还可以产生单态氧用于PDT和光热疗法。表面包被的AF细胞膜使得NPs同源靶向AF,促进癌细胞附近的NPs积累并因此增强光诊断治疗功效。此外,其他药物和成像剂可以加载到这种仿生纳米复合物中,引入超越光学成像和光疗法的多模式治疗诊断平台,为肿瘤诊疗提供新的思路。
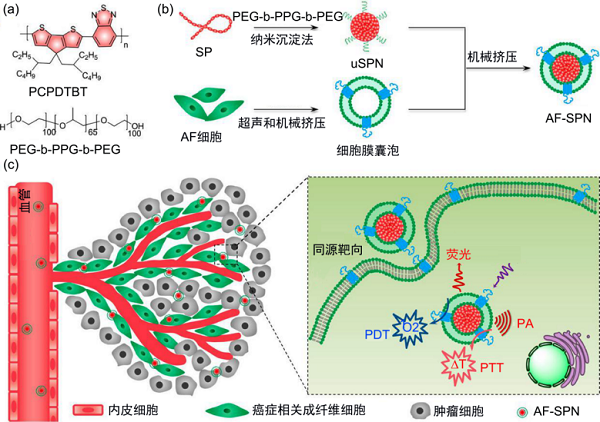
图2 用于增强的多模式癌症光疗法的AF-SPN的制备示意图
肿瘤免疫治疗
自然杀伤(natural killer, NK)细胞作为一种先天免疫效应细胞,其在肿瘤免疫治疗领域引起了广泛的关注。在抗肿瘤免疫治疗中,NK细胞可以诱导巨噬细胞向炎症M1巨噬细胞极化,并通过NK细胞膜中存在的蛋白质(如RANKL或DNAM-1)靶向目标肿瘤【7】。由于NK细胞膜可以诱导M1巨噬细胞的极化,因而成为肿瘤免疫治疗的候选细胞膜之一。Deng等【8】设计了NK细胞膜仿生修饰的NPs,即NK-NPs,用于肿瘤免疫治疗(图3),并最终在动物水平上获得预期的治疗效果。NK细胞膜使NK-NPs在肿瘤中引发巨噬细胞向促炎性M1巨噬细胞极化,从而产生细胞膜介导的免疫治疗。另外,装载在NK-NPs中的光敏剂可以触发PDT诱导免疫原性细胞死亡,并激活APC和损伤相关的分子模式,提高NPs抵抗肿瘤的效率。
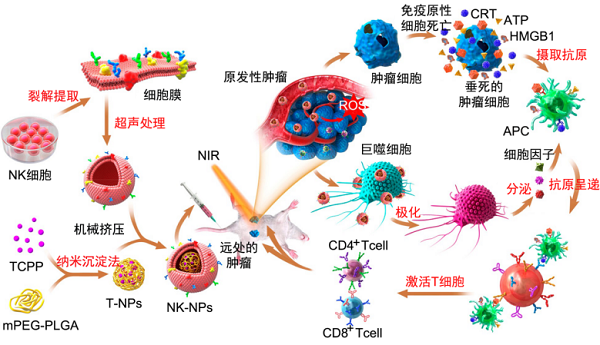
图3 用于PDT增强细胞膜免疫治疗的NK细胞膜修饰纳米粒的制备和肿瘤治疗示意图
展望
CMBMNPs拥有细胞膜的独特功能,例如免疫逃逸、体内延长循环时间或肿瘤靶向,这有助于NPs携带的药物有效积累于肿瘤部位,提高肿瘤治疗效果。虽然CMBMNPs在肿瘤治疗方面已经显示极大的潜力和应用前景,但肿瘤区域的完全穿透仍然是一个难题。尽管将一些肽或配体加载于细胞膜仿生修饰的NPs中可以增强它们的肿瘤穿透能力并有效杀死深层肿瘤细胞。但受限于肿瘤微环境中升高的间质液压和致密的ECM,使NPs无法彻底穿透肿瘤区域【9】。同时,由于肿瘤环境的复杂性和不同肿瘤的各项特性,还需要研究适应于不同肿瘤和不同个体的个性化修饰和载药方案。另一方面,虽然目前已有许多研究表明细胞膜仿生修饰的NPs在体内具有良好的生物相容性,由于癌细胞膜修饰的纳米粒健康器官中仍然存在较多的富集,因此癌细胞膜包被纳米粒对健康器官的生物安全性需要进一步研究。(详情请点击阅读原文)
面向未来,随着各种新兴的仿生纳米技术的开发和成熟,细胞膜仿生修饰的NPs有望成为肿瘤治疗的重要手段,将对人类肿瘤治疗产生更多积极影响。
参考文献:
[1] Anchordoquy T J, Barenholz Y, Boraschi D, et al. Mechanisms and barriers in cancer nanomedicine: addressing challenges, looking for solutions . ACS Nano, 2017, 11(1): 12-18
[2] Peng W, Zhang Y, Zhu R, et al. Comparative membrane proteomics analyses of breast cancer cell lines to understand the molecular mechanism of breast cancer brain metastasis. Electrophoresis, 2017, 38(17): 2124-2134
[3] Zhang D, Ye Z, Wei L, et al. Cell membrane-coated porphyrin metal-organic frameworks for cancer cell targeting and O2-evolving photodynamic therapy. ACS Appl Mater Interfaces, 2019, 11(43): 39594-39602
[4] Harris J C, Scully M A, Day E S. Cancer cell membrane-coated nanoparticles for cancer management. Cancers , 2019, 11(12):2072-6694
[5] Zhu J Y, Zheng D W, Zhang M K, et al. Preferential cancer cell self-recognition and tumor self-targeting by coating nanoparticles with homotypic cancer cell membranes. Nano Lett, 2016, 16(9): 5895-5901
[6] Li J, Zhen X, Lyu Y, et al. Cell membrane coated semiconducting polymer nanoparticles for enhanced multimodal cancer phototheranostics. ACS Nano, 2018, 12(8): 8520-8530
[7] Tian L, Li W, Yang L, et al. Cannabinoid receptor 1 participates in liver inflammation by promoting M1 macrophage polarization via rhoA/NF-kappa β p65 and ERK1/2 pathways, respectively, in mouse liver fibrogenesis. Front Immunol, 2017, 8: 1214
[8] Deng G, Sun Z, Li S, et al. Cell-membrane immunotherapy based on natural killer cell membrane coated nanoparticles for the effective inhibition of primary and abscopal tumor growth. ACS Nano, 2018, 12(12): 12096-12108
[9] Luk B T, Zhang L. Cell membrane-camouflaged nanoparticles for drug delivery. J Control Release, 2015, 220: 600-607
作者简介:
石雯:重庆大学生物工程学院博士研究生,研究方向为可降解材料的毒理作用以及心血管疾病的生物力学机制。
(作者:石雯)
(本文来源于公众号: 生物化学与生物物理进展)
 附件下载:
附件下载: