随着人们物质生活水平的提高,心血管疾病事件已稳居所有威胁人类健康事件的首位。动脉粥样硬化作为中风、心梗、脑梗等心血管事件发病的病理生理基础,受到心血管系统疾病研究者的广泛关注。
细胞内胆固醇水平平衡的打破是促进动脉粥样硬化发生发展的重要危险因素之一。细胞内胆固醇的"一生"可分为合成/摄取、流出、酯化三个阶段。当细胞内游离胆固醇水平降低时,细胞可通过从头合成或摄取途径提高细胞内胆固醇水平。细胞内过多的游离胆固醇则通过流出和酯化达到平衡。因此,许多关于动脉粥样硬化的研究都围绕着胆固醇合成/摄取、流出和酯化展开。在此基础上,他汀类药物、依折麦布等降脂药物随之诞生,并明显延长了动脉粥样硬化患者的生命。这无不明示了解胆固醇的"一生",对动脉粥样硬化"未来"药物及其治疗方案研究具有重要作用。
胆固醇的合成/摄取
机体所有细胞均能合成胆固醇,其中肝脏合成胆固醇占总合成胆固醇的50%。胆固醇生物合成由乙酰辅酶A在20多种酶作用下完成。细胞内固醇调节元件结合蛋白2(sterol regulatory element-binding protein 2,SREBP2)、3-羟基-3-甲基-戊二酰基辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR)和角鲨烯单加氧酶(squalene monooxygenase,SQLE)是胆固醇合成的关键因子。
细胞内胆固醇水平占总脂质水平的5%是细胞内胆固醇合成的"分水岭"。当细胞内胆固醇水平低于5%时,SREBP分裂激活蛋白(SREBP-cleavage activating protein,SCAP)则与蛋白胰岛素诱导基因1(insulin-induced gene 1,INSIG1)分离,使SCAP-SREBP2复合物随即从内质网膜上分解并脱落【1】。脱落后的复合物经COPII转运至高尔基体活化为核SREBP2(nSREBP2)。nSREBP2以同型二聚体形式进入核内,上调HMGCR和SQLE的表达【2-3】(图1)。细胞内胆固醇合成随之增加。他汀类药物能竞争性抑制HMGCR活性,减少细胞内胆固醇生成。
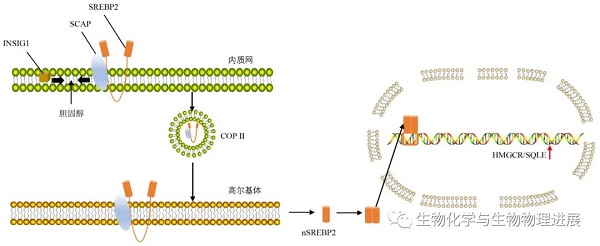
图1:胆固醇合成相关因子调节机制
机体吸收及转运胆固醇的方式,分为食物中胆固醇摄取、低密度脂蛋白(LDL)胆固醇摄取和高密度脂蛋白(HDL)胆固醇摄取。这三个过程分别需要尼曼-匹克C1型类似蛋白1(Niemann-Pick type C1-like 1,NPC1L1)、低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)、B族清道夫受体1 (scavenger receptor class B1,SR-B1)摄取胆固醇。
NPC1L1主要定位于肠细胞和肝脏胆管上皮,在机体内胆固醇充足状态下主要定位于内吞循环囊泡中。在体内胆固醇水平降低时,NPC1L1转运至质膜表面,与肠道中胆固醇结合并转运进细胞内。进入细胞后,NPC1L1与胆固醇分离并返回细胞膜,继续摄取胆固醇。降脂药依折麦布能阻断NPC1L1返回细胞膜,减少肠道胆固醇摄取,降低机体胆固醇值【4】。LDLR是外周细胞从循环中摄取胆固醇的主要受体,约75%的循环胆固醇由LDLR内吞除去【5】。SR-B1是介导胆固醇逆向转运中高密度脂蛋白胆固醇摄取的主要受体。SR-B1能直接与循环中的HDL结合,并选择性摄取其中的胆固醇进入肝脏细胞中进行代谢【6】(图2)。
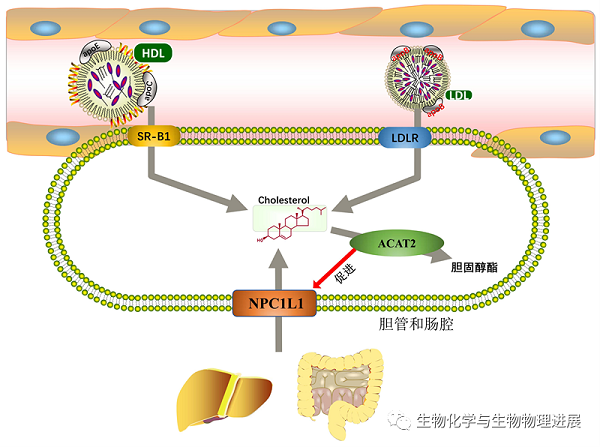
图2:胆固醇摄取机制
胆固醇流出
尽管体内所有细胞均能合成胆固醇,但大多数细胞无法分解胆固醇,需要将多余游离胆固醇排出细胞,或将其转化为胆固醇酯储存在细胞脂滴中。细胞膜上载脂蛋白A-I结合蛋白(apolipoprotein A-I binding protein,AIBP)及4种ATP结合盒式蛋白(ATP-binding cassette transporter,ABC)A1、G1、G5、G8能特异性介导细胞内胆固醇流出。
胆固醇流出是一个连续的过程。细胞内多余的胆固醇通过ABCA1流出至乏酯的apo A-I上,形成新生HDL;新生HDL在卵磷脂胆固醇脂酰转移酶作用下形成成熟HDL,并继续接收ABCG1介导流出的胆固醇。在上述过程中,AIBP能稳定ABCA1与apo A-I的结合,减少ABCA1蛋白降解,增加细胞内胆固醇流出。ABCG5和ABCG8是仅在肝细胞和肠道上皮细胞中表达的半转运体蛋白,它们以异二聚体形式介导细胞内胆固醇和植物固醇流出至胆管和肠腔中【7】(图3)。
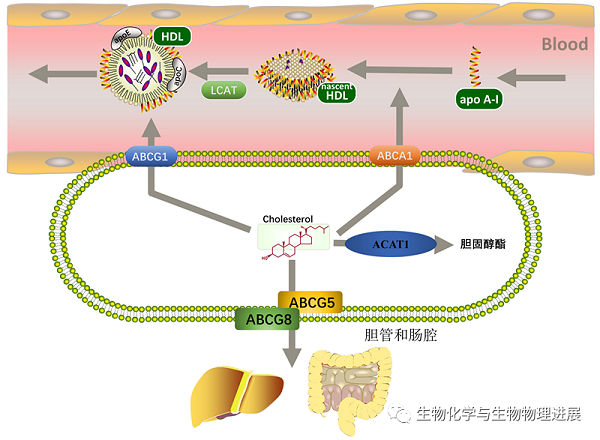
图3:胆固醇流出及酯化
胆固醇酯化
胆固醇酯化是防止细胞内游离胆固醇在细胞内聚集的另一种方式。人酰基辅酶A胆固醇酰基转移酶(acyl coenzyme A:cholesterol acyltransferase,ACAT)可通过胆固醇酯化调节胆固醇的储存或分泌,维持游离胆固醇和胆固醇酯之间的平衡。ACAT1在全身细胞中广泛表达,但在巨噬细胞、上皮细胞和类固醇激素产生细胞表达量明显高于其他细胞。胆固醇是ACAT1的变构激活剂,胆固醇可通过直接结合ACAT1使其活化,激活的ACAT1可酯化细胞内游离胆固醇并储存在脂滴之中【8】(图3)。这种正反馈作用可快速调节细胞内游离胆固醇含量。ACAT2主要在肠上皮细胞中表达,在肝脏中也有微量表达。ACAT2介导胆固醇酯化可增强肠道上皮细胞对胆固醇的吸收【9】(图2)。
展望
胆固醇"一生"三个"阶段"在细胞内胆固醇水平动态调节中发挥重要作用。现有研究已将胆固醇"一生"中各个"阶段"及其之间的转换机制充分展示,在此基础上研发并应用于临床的药物包括HMGCR抑制剂他汀类药物;NPC1L1抑制剂依折麦布;以及增加肝细胞膜表面LDLR的PCSK9单抗等。以上药物单个或联合使用均明显降低患者突发心血管事件的风险。所谓"病从口入",在药物治疗的基础上,减少蛋黄、动物脑、墨斗鱼(乌贼)、蟹黄、蟹膏、肝肾等高胆固醇食物的摄入;适当增加香菇、木耳、青菜、水果食用,是降低细胞胆固醇、减少心血管事件发生的另一重要方式。
尽管针对冠心病治疗已有多种药物及方案,但动脉粥样硬化仍居威胁人类健康安全的疾病之首。以上治疗方案包括胆固醇的合成、摄取,在往后的研究中,动脉粥样硬化新的治疗药物及方案的研究将成为"未来"的主要研究方向,其中尤以ABCA1和ABCG1等胆固醇流出受体相关药物研究更为重要。(详情请点击阅读原文)

参考文献:
[1] Radhakrishnan A, Goldstein J L, Mcdonald J G, et al. Switch-like control of SREBP-2 transport triggered by small changes in ER cholesterol: a delicate balance. Cell Metab, 2008, 8(6): 512-521
[2] Howe V, Sharpe L J, Prabhu A V, et al. New insights into cellular cholesterol acquisition: promoter analysis of human HMGCR and SQLE, two key control enzymes in cholesterol synthesis. Biochim Biophys Acta Mol Cell Biol Lipids, 2017, 1862(7): 647-657
[3] Chen F, Zhou Y, Yang K, et al. NPY stimulates cholesterol synthesis acutely by activating the SREBP2-HMGCR pathway through the Y1 and Y5 receptors in murine hepatocytes. Life Sci, 2020, 262:118478
[4] Betters J L, Yu L. NPC1L1 and cholesterol transport. FEBS Lett, 2010, 584(13): 2740-2747
[5] Yang H X, Zhang M, Long S Y, et al. Cholesterol in LDL receptor recycling and degradation. Clin Chim Acta, 2020, 500:81-86
[6] Zhang Z, Zhou Q, Liu R, et al. The adaptor protein GIPC1 stabilizes the scavenger receptor SR-B1 and increases its cholesterol uptake. J Biol Chem, 2021, 296:100616
[7] Patel S B, Graf G A, Temel R E. ABCG5 and ABCG8: more than a defense against xenosterols. J Lipid Res, 2018, 59(7): 1103-1113
[8] Qian H, Zhao X, Yan R, et al. Structural basis for catalysis and substrate specificity of human ACAT1. Nature, 2020, 581(7808): 333-338
[9] Jiao R, Guan L, Yang N, et al. Frequent cholesterol intake up-regulates intestinal NPC1L1, ACAT2, and MTP. J Agric Food Chem, 2010, 58(9): 5851-5857
作者简介:
张强:南华大学心血管疾病研究所硕士研究生,主要研究方向为动脉粥样硬化中胆固醇逆转运及其机制研究。
(作者:张强)
(本文来源于公众号: 生物化学与生物物理进展)
 附件下载:
附件下载: