随着社会的进步和发展,越来越多的人意识到运动与机体抗感染能力之间存在着微妙的关系。众所周知,适度的运动对机体免疫系统有着积极健康的影响,而大强度运动反之。再者,运动又与线粒体的关系密切。线粒体是真核生物细胞中最重要的细胞器之一。随着对它认识的不断深入,人们发现线粒体的功能不仅仅局限于能量的供应,还涉及到了先天性免疫。因此,研究者们提出--运动是否能够通过刺激线粒体来调控先天性免疫呢?
先天性免疫又称固有免疫,是机体防御外界病原微生物入侵的第一道防线。固有免疫信号产生的过程是由细胞模式识别受体(pattern recognition receptors, PRRs)来识别相应的病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)从而激活先天性免疫信号通路产生干扰素、炎症因子和趋化因子等来消灭入侵的外界病原微生物【1】。目前已经发现的PRRs主要包括Toll 样受体(Toll-like receptors, TLRs)、Nod 样受体(Nod-like receptors, NLRs)、RIG-I 样受体(RIG-I-like receptor, RLRs)和黑色素瘤缺乏因子2(absent in melanoma 2, AIM2)受体等。PAMPs是病原微生物进化过程中相对保守的分子,主要是病原微生物的核酸,包括DNA (未甲基化CpG 序列)、双链RNA、单链RNA、5'-三磷酸核糖核酸、脂蛋白和细胞表面糖蛋白【2】。
作为运动能量来源的核心细胞器,线粒体是从细菌进化而来的内共生体,其在特定能量代谢条件下形成的线粒体相关分子模式(damage associated molecular patterns, DAMPs)可作为先天性免疫激活信号。在正常生理条件下,老化的线粒体和损伤的线粒体在细胞内通过线粒体自噬的方式来避免DAMPs的积累。当线粒体自噬被抑制或者受损伤的线粒体在细胞内积聚从而超过了自噬清除受损线粒体的能力,此时损伤的线粒体则通过释放多种DAMPs与PRRs 受体结合来引发先天性免疫应答。结合运动强度与上呼吸道感染率之间存在着J 型曲线关系【3】,我们会容易想到,适当的运动强度是否能通过刺激线粒体释放DAMPs来加强先天性免疫应答,从而增强免疫细胞的抗感染能力呢?事实真的如此吗?
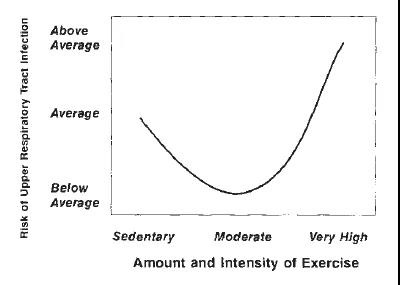
运动强度与上呼吸道感染率的J型曲线模式【3】
研究发现,人在一次性有氧运动(最大摄氧量60%)54 min以及90 min后即刻,其血浆游离线粒体DNA(mtDNA)水平均显著降低【4】。显示规律的中等强度的有氧运动减少了mtDNA的释放,这可能减缓了其触发的无菌炎症。的确,长期有氧运动可以下调血液白细胞促炎基因的表达,上调抗炎基因表达【5-6】。另外,相对于不运动的小鼠,6 周的自主跑轮运动降低造血干/祖细胞(hematopoietic stem and progenitor cell, HSPC)的增殖,从而降低促炎性白细胞的生成。这时你是否会认为促炎性白细胞的下降会导致免疫力低下?然而进一步研究发现,促炎性白细胞的减少并未降低小鼠的免疫力,反而增强了小鼠的抗感染能力【7】。是不是很意外?中等强度规律运动的抗炎作用反而与免疫功能的增强有关。事实上,中等强度耐力运动有利于保持线粒体的健康,这可能联系着线粒体DAMPs释放的减少。研究发现,1周的中等强度耐力运动就能使比目鱼肌中线粒体心磷脂的含量增加,有利于维持线粒体的健康【8】。
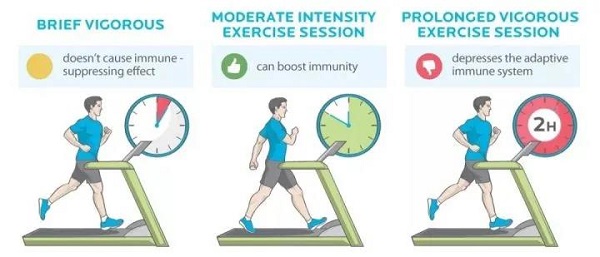
不出所料,大强度运动则主要对机体起促炎作用。研究发现,健康男性在一次性急性大强度运动后,血清游离的mtDNA水平显著升高【9】。并且大强度运动导致肌肉损伤,其释放高迁移率族蛋白B1(high-mobility group box 1 protein, HMGB1)和mtDNA,能够分别通过TLR4和TLR9来激活炎症反应【10】。这些研究表明,大强度运动导致大量骨骼肌mtDNA释放进入血液循环,进而刺激炎症反应。然而,血液中大量的DAMPs激活了免疫系统的无菌炎症,这与免疫细胞的功能障碍有关。事实上,大强度运动也导致了骨骼肌线粒体损伤【11】,并且短期高强度运动就可导致外周血白细胞线粒体功能障碍,并伴有凋亡倾向增加和促炎介质升高,这些结果支持了过度运动介导的免疫抑制作用【12】。
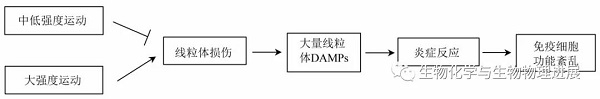
运动介导线粒体DAMPs调控先天性免疫的可能机制
这下是不是豁然开朗?那我们平时只需要注意运动强度,进行适当强度的体育锻炼就可以开开心心的增强免疫力了!但是也必须注意锻炼结束后对自己身体的保护。因为运动后即刻,我们的身体都处于免疫力低下的状态,极易受到病毒感染。这是为什么呢?因为研究发现,乳酸的生成联系着RLRs信号介导的I型干扰素(IFN-I)下降【13】。而IFN-I是激活身体抗病毒因子产生的关键。这个时候你可能要问了,乳酸不是剧烈运动后才产生的吗?我不去做剧烈运动不就好了吗?然而,中等强度耐力运动也能导致乳酸的生成增多【14】。因此,虽然适当强度的运动可以增强机体的抗感染能力,但是运动结束后即刻增多的乳酸仍然可能直接抑制先天性免疫从而导致受感染的风险增加。因此,注意体育锻炼后的自我保护是十分重要的!(详情请点击阅读原文)

参考文献
[1] Takeuchi O, Akira S. Innate immunity to virus infection. Immunol Rev, 2009, 227(1): 75-86
[2] Tang D, Kang R, Coyne C B, et al. PAMPs and DAMPs: signal 0s that spur autophagy and immunity. Immunol Rev, 2012, 249(1): 158-175
[3] Nieman D C. Exercise, infection, and immunity. Int J Sports Med, 1994, 15 Suppl 3: S131-S141
[4] Shockett P E, Khanal J, Sitaula A, et al. Plasma cell-free mitochondrial DNA declines in response to prolonged moderate aerobic exercise. Physiol Rep, 2016, 4(1):e12672
[5] Liu D, Wang R, Grant A R, et al. Immune adaptation to chronic intense exercise training: new microarray evidence. BMC Genomics, 2017, 18(1): 29
[6] Iyalomhe O, Chen Y, Allard J, et al. A standardized randomized 6-month aerobic exercise-training down-regulated pro-inflammatory genes, but up-regulated anti-inflammatory, neuron survival and axon growth-related genes. Exp Gerontol, 2015, 69: 159-169
[7] Frodermann V, Rohde D, Courties G, et al. Exercise reduces inflammatory cell production and cardiovascular inflammation via instruction of hematopoietic progenitor cells. Nat Med, 2019, 25(11): 1761-1771
[8] Faber C, Zhu Z J, Castellino S, et al. Cardiolipin profiles as a potential biomarker of mitochondrial health in diet-induced obese mice subjected to exercise, diet-restriction and ephedrine treatment. J Appl Toxicol, 2014, 34(11): 1122-1129
[9] Stawski R, Walczak K, Kosielski P, et al. Repeated bouts of exhaustive exercise increase circulating cell free nuclear and mitochondrial DNA without development of tolerance in healthy men. PLoS One, 2017, 12(5): e178216
[10] Mccarthy C G, Webb R C. The toll of the gridiron: damage-associated molecular patterns and hypertension in American football. FASEB J, 2016, 30(1): 34-40
[11] Lee S, Kim M, Lim W, et al. Strenuous exercise induces mitochondrial damage in skeletal muscle of old mice. Biochem Biophys Res Commun, 2015, 461(2): 354-360
[12] Tuan T C, Hsu T G, Fong M C, et al. Deleterious effects of short-term, high-intensity exercise on immune function: evidence from leucocyte mitochondrial alterations and apoptosis. Br J Sports Med, 2008, 42(1): 11-15
[13] Zhang W, Wang G, Xu Z G, et al. Lactate is a natural suppressor of RLR signaling by targeting MAVS. Cell, 2019, 178(1): 176-189[14] Stanley W C, Wisneski J A, Gertz E W, et al. Glucose and lactate interrelations during moderate-intensity exercise in humans. Metabolism, 1988, 37(9): 850-858
作者简介
戈哲:深圳大学体育学院助理教授,主要研究方向为运动与肿瘤免疫。
(作者:戈哲)
(本文来源于公众号: 生物化学与生物物理进展)
 附件下载:
附件下载: