
冯巍研究组与赵岩研究组合作揭示
衔接蛋白复合物AP-4的构象动态性在囊泡运输中的关键作用
在真核细胞内,细胞器之间持续进行着高度有序而繁忙的物质交换。为确保重要膜蛋白被精准递送至特定细胞区域,细胞依赖精密的胞内囊泡运输系统。其中,负责连接货物选择与囊泡形成的衔接蛋白复合物(adaptor protein (AP) complexes)发挥着核心作用。AP-4是AP家族的重要成员,其不依赖网格蛋白(clathrin)形成囊泡,主要介导特定的货物蛋白从反式高尔基网络(TGN)向下游细胞区域的运输过程。已有研究表明,AP-4功能缺陷会导致ATG9A等关键货物蛋白在细胞内异常滞留,并与多种严重的神经发育障碍密切相关。然而,AP-4如何被招募至膜表面,以及其结构特性如何支持这一过程,长期以来缺乏系统性的结构与分子机制解释。
2026年1月21日,冯巍研究团队和赵岩研究团队在《Nature Communications》发表题为"Structural basis for the dynamic conformations of AP-4 and its association with ARF1"的研究论文,系统揭示了AP-4的构象动态特性及其在膜招募和货物转运过程中的关键作用机制。
研究团队首先通过体外重组获得可溶状态下的AP-4核心复合物,并利用单颗粒冷冻电镜技术解析其整体三维结构。结果显示,AP-4并非一个静态的刚性复合物,而是在"闭合态"和"开放态"之间维持动态平衡。进一步分析发现,这种构象可塑性主要源于中等亚基μ4与核心骨架(以β4亚基为主)之间相对松散的相互作用界面,为AP-4在不同功能状态下的构象转换提供结构基础。
在此之后,研究进一步解析AP-4与其关键调控因子ARF1的复合物结构。结果表明,ARF1的结合并未诱导AP-4发生显著的构象重排,而是通过特定局部区域识别的方式与AP-4相互作用,使其仍然保持构象动态平衡的状态。这一发现提示,ARF1并非通过"锁定"特定构象来激活AP-4,而更可能在一个动态构象体系中精细调控其膜招募过程。与此同时,单分子FRET实验进一步验证了 AP-4的构象动态特性。通过分析AP-4/ARF1复合物的结构,并结合关键作用界面的突变研究,进一步确认该相互作用对AP-4膜招募至关重要。研究还发现,破坏AP-4构象的动态平衡会削弱ARF1与ATG9A对AP-4招募过程的协同作用,导致ATG9A在细胞内出现异常定位。
综合上述实验结果,该研究提出AP-4膜招募的工作模型:AP-4作为一个构象动态的衔接蛋白复合物,其高效膜招募及功能执行依赖于ARF1与货物蛋白的协同参与;当AP-4的构象动态性被破坏,这种协同效应随之丧失,最终造成囊泡运输过程受阻。因此,该研究从构象调控的角度重新界定AP-4膜招募的作用方式,为理解AP-4相关神经发育疾病的分子基础提供重要线索,也为深入认识囊泡运输的调控机制提供相关结构与机制框架。
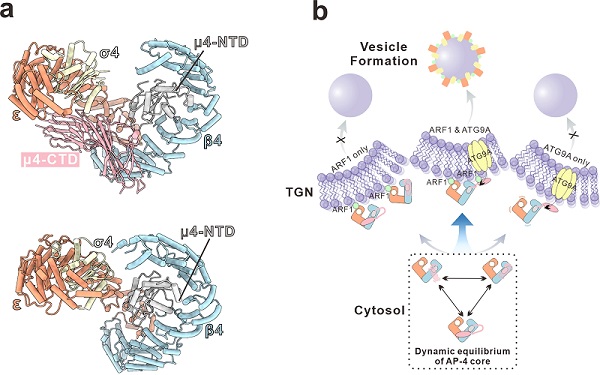
图:AP-4核心复合物的冷冻电镜结构及其膜招募的工作模型
中国科学院生物物理研究所冯巍研究员和赵岩研究员为该论文的共同通讯作者,冯巍组博士研究生汪杨慧、李薇副研究员、赵岩组博士研究生邱云龙以及吴思研究员为论文的共同第一作者,中山大学洪柳教授也为该研究贡献了力量。该研究得到"脑科学与类脑研究"国家科技重大专项、中国科学院稳定支持基础研究领域青年团队计划以及国家自然科学基金等项目的资助。
文章链接:
https://www.nature.com/articles/s41467-026-68679-8
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202601/t20260123_1146486.shtml
(供稿:冯巍研究组)
附件下载: