
载脂蛋白E如何掌管脂质稳态,影响神经疾病?
当我们谈论大脑健康时,往往聚焦于神经元的数量、电信号传递、突触的连接强度,却往往忽视了一种关键物质"脂质"。作为大脑中含量最高的有机物(占干重的50%以上),脂质不仅是神经细胞膜的主要成分之一,更是维持信号传导、能量代谢的关键分子。假如把大脑比喻为一座由数百亿神经元组成的精密工厂,神经元是机器,脂质(胆固醇、磷脂等)就好比是润滑油。维持这座工厂高效运转的关键,就在于确保脂质的供应、运输和使用始终处于一种精密的动态平衡状态,我们称之为大脑脂质稳态。而大脑的脂质稳态,更像一场精密的"物流调控",需要多种蛋白质协同运作。载脂蛋白E(apolipoprotein E,ApoE)则像是"分子货车",负责把需要的各种脂质精准投递到神经元。ApoE的功能异常可能打破这场平衡,成为阿尔茨海默病(Alzheimer's disease,AD)、脑血管病等神经退行性疾病的推手。
大脑脂质稳态
要理解ApoE的作用,首先需要认识大脑"脂质稳态"的重要性。
神经细胞(神经元、神经胶质细胞)功能高度依赖脂质。脂质是神经元细胞膜的核心成分,如果胆固醇含量异常会导致膜流动性失衡,直接影响神经元的信号接收与传递;脂质稳态破坏还会导致突触结构萎缩或功能障碍,引发学习记忆衰退;脂质又影响着髓鞘的形成与维护、轴突运输的动力支持,这都关系到神经信号高效传导;此外,脂质不仅是直接的信号分子,神经递质合成与释放,如某些脂质是神经递质(如多巴胺、血清素)合成酶的激活剂,其稳态为神经递质的稳定产生提供保障,稳态失衡则可能导致抑郁症发生。多种神经系统疾病都发现与脂质稳态相关。
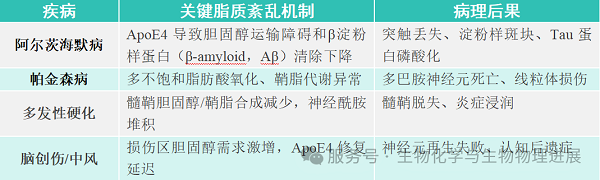
正是因为大脑中种类繁多的脂质,形成了复杂的功能网络,大脑的正常功能才能得以维持。这些脂质并非静止存在,而是处于动态平衡中。神经细胞不断合成新的脂质,通过特定蛋白转运到需要的部位(如突触、髓鞘),而老化或受损的脂质会被分解为小分子,后被重新利用或被代谢掉。且在神经炎症、组织缺血等应激条件刺激下,脂质组成会快速调整以维持细胞存活。这种平衡一旦被打破,可能引发一系列连锁反应,如胆固醇堆积会导致淀粉样蛋白沉积,鞘脂代谢异常会破坏髓鞘完整性,最终影响神经元功能。
ApoE:大脑脂质的调节器
ApoE作为大脑中脂质和胆固醇的主要转运蛋白,主要由神经胶质细胞产生,在脂蛋白代谢和胆固醇的再分布中起着关键作用。且ApoE可清除炎症分子和致病分子,使ApoE在免疫功能中发挥作用[1]。长期以来,ApoE一直是动脉粥样硬化和心血管疾病领域研究的重点对象。正常情况下,ApoE把由星形胶质细胞生成的胆固醇、磷脂裹成脂蛋白颗粒。通过 低密度脂蛋白受体(LDLR)、低密度脂蛋白受体相关蛋白1(LRP1)等受体把脂质送进神经元或髓鞘细胞,用于修突触、长轴突[2-3]。作用结束后,多余的脂质被带回星形胶质细胞循环利用。

然而,ApoE并非千篇一律。决定其结构和功能的关键,在于其基因编码存在三种常见的变异形式,分别产生ApoE2、ApoE3和ApoE4蛋白,其中ApoE4是多种神经疾病的高危因子。尽管三者的对大脑的健康程度影响甚大,但三种蛋白质仅存在两个位点的氨基酸区别。ApoE3是最常见的亚型(约占人群70%),脂质转运效率适中,能稳定维持大脑脂质平衡。ApoE2的脂质结合能力最强,转运效率高,有研究发现,ApoE2甚至可能降低某些疾病风险(如脑血管病)。
而ApoE4的脂质结合能力弱,其运输效率低下。ApoE4无法及时将神经元产生的代谢垃圾(如氧化胆固醇)运出,导致脂质在细胞内堆积,诱发氧化应激;ApoE4还会与大脑中的Aβ结合,促进其聚集形成炎性斑块,这成为了AD的典型病理特征[4-5];大脑高胆固醇负荷也可诱导血脑屏障损伤,让外周有害物质更容易侵入大脑,加重炎症和神经胶质细胞介导的慢性炎症[6-7]。
数据显示,ApoE4是AD的最强遗传风险因素,约60%~80% AD患者为ApoE4携带者,携带一个 ApoE4 等位基因会增加3~4倍患晚发型AD的风险,携带两个等位基因会增加9~15倍患病风险[8]。在脑血管病中,ApoE4也会通过促进脂质沉积加速动脉硬化,增加中风风险[9]。
靶向ApoE的疾病干预思路
鉴于ApoE4在破坏大脑脂质稳态、驱动神经退行性疾病中的核心作用,它自然成为科学家们寻求干预策略的关键靶点。
策略一,增强脂质转运:研发模拟ApoE2功能的药物,以此来补充提高ApoE4的脂质结合能力,帮助清理堆积的脂质[10]。
策略二,抑制ApoE4的有害作用:通过小分子药物阻断ApoE4与淀粉样蛋白的结合,减少斑块形成,以达到改善AD的作用[11-12]。
策略三,降低ApoE4水平:由于ApoE4与AD高发病率之间的关系,多项研究意在寻找降低ApoE4表达水平以降低其对大脑造成的病理损伤。例如开发直接作用于ApoE4的单克隆抗体[13];通过基因编辑沉默ApoE4基因表达[14];或通过反义寡核苷酸(ASO)通过序列特异地抑制ApoE4表达,也有望成为治疗神经系统疾病的潜在方法[15]。
策略四,生活方式调控:饮食中的Omega-3脂肪酸、膳食纤维等,可能通过改善脂质代谢,部分抵消ApoE4的风险。已有研究显示,地中海饮食可降低ApoE4携带者的AD发病率[16]。
此外,在研究中发现,一些老药、中药(如二甲双胍[17]、白藜芦醇[18]等)可能也在ApoE的作用过程中起调节作用,为ApoE的作用机制和新药开发提供思路。虽然研究进展迅速,但大多数治疗方法依旧只停留在动物研究,或者早期临床试验阶段。效果不足或副作用的产生让我们意识到,ApoE4的作用是多面的,脂质稳态可能只是其中一个重要的部分,全面综合治疗可能为未来主攻方向。这些研究不仅为疾病防治提供了新靶点,更揭示了一个核心规律:大脑的健康,离不开脂质稳态的"精细平衡",而ApoE正是这场平衡的关键因子。(详情请点击阅读原文)
大脑占体重2%,却含全身25%的胆固醇!每一次思考、记忆、行动,都依赖脂质稳态的无声护航。研发靶向脂质稳态的神经疾病干预方法具有广泛的前景。
参考文献
[1] Tudorache I F, Trusca V G, Gafencu A V. Apolipoprotein E - A multifunctional protein with implications in various pathologies as a result of its structural features. Comput Struct Biotechnol J, 2017, 15: 359-365
[2] Huynh T V, Davis A A, Ulrich J D, et al. Apolipoprotein E and Alzheimer's disease: the influence of apolipoprotein E on amyloid-β and other amyloidogenic proteins. J Lipid Res, 2017, 58(5): 824-836
[3] Lee H, Aylward A J, Pearse R V 2nd, et al. Cell-type-specific regulation of APOE and CLU levels in human neurons by the Alzheimer's disease risk gene SORL1. Cell Rep, 2023, 42(8): 112994
[4] Verghese P B, Castellano J M, Holtzman D M. Apolipoprotein E in Alzheimer's disease and other neurological disorders. Lancet Neurol, 2011, 10(3): 241-252
[5] Castellano J M, Kim J, Stewart F R, et al. Human apoE isoforms differentially regulate brain amyloid-β peptide clearance. Sci Transl Med, 2011, 3(89): 89ra57
[6] Chen Y, Yin M, Cao X, et al. Pro- and anti-inflammatory effects of high cholesterol diet on aged brain. Aging Dis, 2018, 9(3): 374-390
[7] Duong M T, Nasrallah I M, Wolk D A, et al. Cholesterol, atherosclerosis, and APOE in vascular contributions to cognitive impairment and dementia (VCID): potential mechanisms and therapy. Front Aging Neurosci, 2021, 13: 647990
[8] Neu S C, Pa J, Kukull W, et al. Apolipoprotein E genotype and sex risk factors for Alzheimer disease: a meta-analysis. JAMA Neurol, 2017, 74(10): 1178-1189
[9] Li Z, Shue F, Zhao N, et al. APOE2: protective mechanism and therapeutic implications for Alzheimer's disease. Mol Neurodegener, 2020, 15(1): 63
[10] Feng M, Cui D, Li Y, et al. Carnosic acid reverses the inhibition of ApoE4 on cell surface level of ApoER2 and reelin signaling pathway. J Alzheimers Dis, 2020, 73(2): 517-528
[11] Chen Y, Song S, Parhizkar S, et al. APOE3ch alters microglial response and suppresses Aβ-induced tau seeding and spread. Cell, 2024, 187(2): 428-445.e20
[12] Marino C, Perez-Corredor P, O'Hare M, et al. APOE Christchurch-mimetic therapeutic antibody reduces APOE-mediated toxicity and tau phosphorylation. Alzheimers Dement, 2024, 20(2): 819-836
[13] Gratuze M, Jiang H, Wang C, et al. APOE antibody inhibits aβ-associated tau seeding and spreading in a mouse model. Ann Neurol, 2022, 91(6): 847-852
[14] Bales K R, Verina T, Dodel R C, et al. Lack of apolipoprotein E dramatically reduces amyloid beta-peptide deposition. Nat Genet, 1997, 17(3): 263-264
[15] Leavitt B R, Tabrizi S J. Antisense oligonucleotides for neurodegeneration. Science, 2020, 367(6485): 1428-1429
[16] Zhang X, Yuan T, Chen X, et al. Effects of DHA on cognitive dysfunction in aging and Alzheimer's disease: The mediating roles of ApoE. Prog Lipid Res, 2024, 93: 101256
[17] Zhang J, Lin Y, Dai X, et al. Metformin treatment improves the spatial memory of aged mice in an APOE genotype-dependent manner. FASEB J, 2019, 33(6): 7748-7757
[18] Chen M H, Liu X Z, Qu X W, et al. ApoE-modified liposomes encapsulating resveratrol and salidroside alleviate manifestations of Alzheimer's disease in APP/PS-1 mice. Drug Dev Ind Pharm, 2023, 49(9): 559-571
作者简介
陈是燏:宁波大学医学部基础医学院研究生;研究方向:抑郁症的病理机制与干预治疗研究。
应佳芹:宁波大学医学部基础医学院本科生;研究方向:阿尔茨海默病的病理机制与中药治疗研究。
李丽萍:宁波大学医学部基础医学院副教授;研究方向:阿尔茨海默病的病理机制与干预治疗研究。
(作者:陈是燏、应佳芹、李丽萍)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: