A)ORF33参与MHV-68病毒组装释放的机理研究
ORF33是疱疹病毒家族中保守的一种间质蛋白。邓红雨课题组的前期研究发现,ORF33对病毒形态发生是必需的,并且在病毒颗粒核释放和间质化过程中起双重作用(Guo et al., J Virol, 2009)。为了进一步揭示ORF33参与病毒形态发生的分子机理,我们综合利用生物化学和生物成像等多种技术手段,发现ORF33最早在细胞核内就可以结合到病毒颗粒上,有力的提出并证明了间质化最早在病毒出核膜前就可以发生的观点。该研究成果已发表在今年J Virol 杂志上。
B)MHV-68 裂解期蛋白ORF48的功能鉴定
鼠疱疹病毒-68(MHV-68)作为研究KSHV及EBV的良好模型,在其由潜伏期到裂解期过渡中也编码一个重要的、功能保守的“分子开关”蛋白:RTA,以促进下游早期基因的转录表达,激活病毒裂解期复制。我们最近发现RTA能够直接结合在ORF48启动子区域的ORF48pRRE顺式元件上,调控ORF48的转录起始。通过构建ORF48缺失突变型病毒,我们发现ORF48的缺失导致病毒在体外细胞系和小鼠肺脏中的裂解复制能力及在小鼠脾脏中的再激活能力显著降低。这进一步增加了我们对于致瘤疱疹病毒转录调控及病毒复制机理的认识。该研究成果已发表在今年J Virol 杂志上,并被选为当期亮点。

图示:作为RTA的下游激活基因产物,ORF48对病毒的体外和体内复制能力至关重要。
C) HCV通过抑制TNF-α诱导的NF-κB激活而实现免疫逃逸
临床数据显示,丙肝病毒感染者的血液中会有较高浓度的肿瘤坏死因子TNF-α。通常情况下TNF-α会激活NF-κB信号通路,从而帮助机体抵抗病毒感染,但丙肝病毒感染者体内的NF-κB信号却处于受抑制的状态。我们研究发现,HCV的NS3蛋白通过与NF-κB信号通路上的一个关键调控蛋白复合物LUBAC相互作用,竞争性地阻碍了LUBAC与IKK复合物中NEMO的结合,使NEMO不能线性泛素化,最终导致NF-κB的激活受到抑制,从而帮助HCV完成免疫逃逸。该研究成果已发表在今年的Science Signaling杂志。
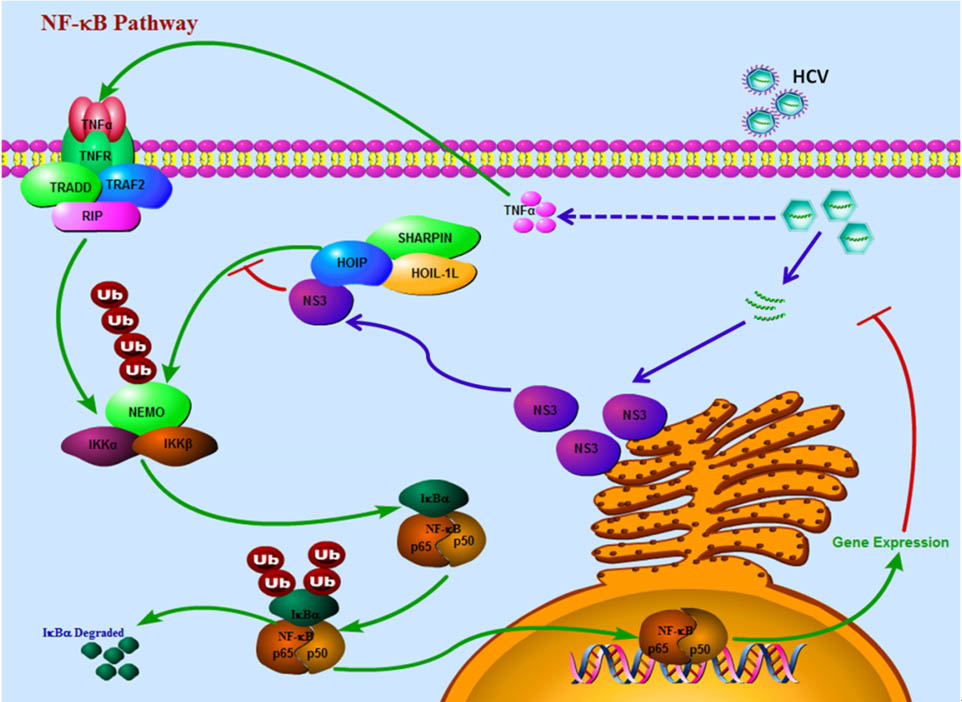
图示:HCV的NS3蛋白抑制NF-κB信号通路的激活。
